题目内容
7.丁烷催化裂化时碳碳键按两种方式断裂,生成两种烷烃和两种烯烃.如果丁烷的裂化率为60%,且裂化生成的两种烯烃物质的量相等,则裂化后得到的含氢质量分数最高的气体占混合气体的体积分数为( )| A. | 18.75% | B. | 30% | C. | 15% | D. | 22.5% |
分析 丁烷结构简式为:CH3-CH2-CH2-CH3,断键位置只有两种, ,故可生成甲烷、丙烯、乙烷、乙烯四种物质,设丁烷的物质的量为1mol,裂解成CH4和C3H6为xmol,裂解成C2H6和C2H4为ymol,裂化生成的两种烯烃物质的量相等,则x=y,根据各个物理量之间的关系式列方程组计算.
,故可生成甲烷、丙烯、乙烷、乙烯四种物质,设丁烷的物质的量为1mol,裂解成CH4和C3H6为xmol,裂解成C2H6和C2H4为ymol,裂化生成的两种烯烃物质的量相等,则x=y,根据各个物理量之间的关系式列方程组计算.
解答 解:丁烷结构简式为:CH3-CH2-CH2-CH3,断键位置只有两种, ,故可生成甲烷、丙烯、乙烷、乙烯四种物质,设丁烷的物质的量为1mol,裂解成CH4和C3H6为xmol,裂解成C2H6和C2H4为ymol,裂化生成的两种烯烃物质的量相等,则x=y,
,故可生成甲烷、丙烯、乙烷、乙烯四种物质,设丁烷的物质的量为1mol,裂解成CH4和C3H6为xmol,裂解成C2H6和C2H4为ymol,裂化生成的两种烯烃物质的量相等,则x=y,
则$\left\{\begin{array}{l}{x+y=1×60%}\\{x=y}\end{array}\right.$,$\left\{\begin{array}{l}{x=0.3}\\{y=0.3}\end{array}\right.$,
含氢质量分数最高的是甲烷,其物质的量为0.3mol,因为是相同条件下,气体摩尔体积相同,甲烷的物质的量分数就等于甲烷占混合气体的体积分数=$\frac{0.3mol}{0.3mol×4+1mol×(1-60%)}×100%$=18.75%,故选A.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确烷烃裂解原理是解本题关键,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
17.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为 .
.

可能用到的有关数据如下:
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为
 .
.
18.将两个铂电极用导线连接,放置在NaOH溶液中,然后向两极分别通入甲烷和氧气,下列叙述正确的是( )
| A. | 正极反应式为O2+4e-═2O2- | |
| B. | 放电时溶液中的阳离子向正极方向移动 | |
| C. | 该电池反应为CH4+2O2═CO2+2H2O | |
| D. | 通入CH4一极的电极反应式为CH4+2O2+8e-═CO2+2H2O |
15.滴定分析法按反应类型一般可以分为__类.( )
| A. | 二 | B. | 一 | C. | 四 | D. | 三 |
2.NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 6.4gCu在足量的硫蒸气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LSO2和SO3的混合物中硫原子数为0.5NA | |
| C. | 1L0.1mol•L-1的NH4Cl溶液中NH4+数目为0.1NA | |
| D. | 通常情况下,3.4gNH3中共用电子对数为0.8NA |
12.下列除去杂质(括号的物质为杂质)的方法中,正确的是( )
| A. | FeCl2溶液(FeCl3):加入过量Cu后过滤 | |
| B. | Na2CO3固体(NaHCO3):加热 | |
| C. | CH3COOCH2CH3(CH3COOH):加NaOH溶液后振荡、分液 | |
| D. | Cl2(HCl):通过NaOH溶液后干燥 |
19.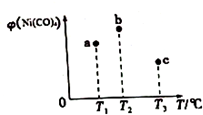 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )| A. | 正反应为吸热反应,平衡常数:K(T1)>K(T2) | |
| B. | 反应进行到5min时,b容器中v(正)=v(逆) | |
| C. | 达到平衡时,a、b、c中CO的转化率为b>a>c | |
| D. | 减压或升温可将b中的平衡状态转变成c中的平衡状态 |
20.铅及其化合物在生产及生活中都具有非常广泛的用途.
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H=a kJ•mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H=b kJ•mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H=c kJ•mol-1
反应3PbS(s)+6O2(g)═3PbSO4(s)△H=2a+2b-3ckJ•mol-1(用含a、b、c的代数式表示)
(2)还原法炼铅,包含反应PbO(s)+CO(g)?Pb(s)+CO2(g)△H,该反应的平衡常数的对数值与温度的关系如下表.
①该还原反应的△H<0(填“>”、“<”或“=”).
②当lg K=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为9.09%.
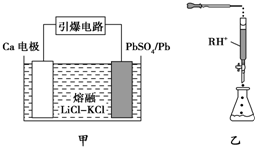
(3)引爆导弹、核武器的工作电源通常是Ca/PbSO4热电池,其装置如图甲所示,该电池正极的电极反应式为PbSO4+2e-═SO42-+Pb(或PbSO4+Ca2++2e-═CaSO4+Pb).
(4)PbI2可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb2++2H++2I-,用250mL洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图乙),加入酚酞指示剂,用0.002 5mol•L-1 NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时 PbI2的Ksp为4×10-9.
(5)铅易造成环境污染.水溶液中铅的存在形态主要有6种,它们与pH关系如图丙所示.含铅废水用活性炭进行处理,铅的去除率与pH关系如图丁所示.
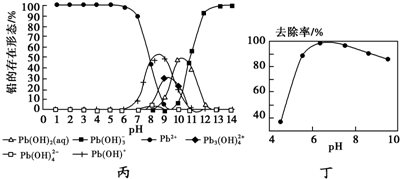
①常温下,pH=6~7时,铅形态间转化的离子方程式为Pb2++H2O?Pb(OH)++H+.
②用活性炭处理,铅的去除率较高时,铅主要应该处于Pb2+形态.(填化学式)
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H=a kJ•mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H=b kJ•mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H=c kJ•mol-1
反应3PbS(s)+6O2(g)═3PbSO4(s)△H=2a+2b-3ckJ•mol-1(用含a、b、c的代数式表示)
(2)还原法炼铅,包含反应PbO(s)+CO(g)?Pb(s)+CO2(g)△H,该反应的平衡常数的对数值与温度的关系如下表.
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
②当lg K=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为9.09%.
(3)引爆导弹、核武器的工作电源通常是Ca/PbSO4热电池,其装置如图甲所示,该电池正极的电极反应式为PbSO4+2e-═SO42-+Pb(或PbSO4+Ca2++2e-═CaSO4+Pb).
(4)PbI2可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb2++2H++2I-,用250mL洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图乙),加入酚酞指示剂,用0.002 5mol•L-1 NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时 PbI2的Ksp为4×10-9.

(5)铅易造成环境污染.水溶液中铅的存在形态主要有6种,它们与pH关系如图丙所示.含铅废水用活性炭进行处理,铅的去除率与pH关系如图丁所示.

①常温下,pH=6~7时,铅形态间转化的离子方程式为Pb2++H2O?Pb(OH)++H+.
②用活性炭处理,铅的去除率较高时,铅主要应该处于Pb2+形态.(填化学式)