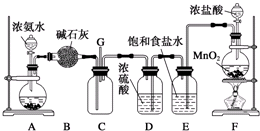
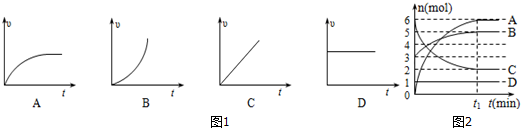
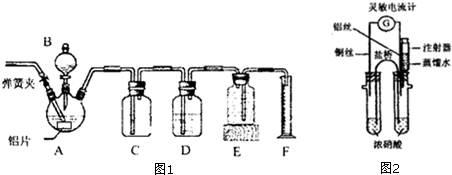
题目内容
14.有4g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到7.5g沉淀.这种铁的氧化物的化学式是( )| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeO和Fe2O3 |
分析 由生成的CO2全部通入足量澄清石灰水中,得到7.5g沉淀,则n(CaCO3)=$\frac{7.5g}{100g/mol}$=0.075mol,由CO~CO2可知,铁的氧化物中的n(O)=0.075mol,再计算Fe的物质的量,可确定化学式,以此来解答.
解答 解:由生成的CO2全部通入足量澄清石灰水中,得到7.5g沉淀,则n(CaCO3)=$\frac{7.5g}{100g/mol}$=0.075mol,由CO~CO2可知,铁的氧化物中的n(O)=0.075mol,
n(Fe)=$\frac{4g-0.075mol×16g/mol}{56g/mol}$=0.05mol,
n(Fe):n(O)=0.05mol:0.075mol=2:3,
则铁的氧化物为Fe2O3,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握铁的氧化物中O原子物质的量计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
5.为测定空气中CO2含量,做下述实验:
(1)为配置标准溶液,请选取必需的一组仪器B;
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
A、①②⑤⑥B、②④⑤⑥⑦C、①②⑥⑦D、②④⑤⑥
(2)滴定操作时,左手控制酸式滴定管活塞,眼睛注视液滴下滴速度和锥形瓶中溶液颜色的变化;
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤.需过滤的原因是除去BaCO3沉淀,使滤液只含Ba(OH)2,以保证实验成功;
(4)①本实验中,用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液时,由于操作不当,滴定结束后滴定管尖嘴处有一气泡,则实际用去盐酸大于19.60mL(填大于、小于、等于)
②若滴定Ba(OH)2溶液时使用的酸式滴定管未经处理,即换0.01mol•L-1盐酸溶液进行第二次滴定,导致算出空气中CO2值(填偏高、偏低或无影响)偏低.
(5)由实验数据算出空气中CO2的体积分数为0.025%.
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收10L空气中的CO2(标准状况) | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
A、①②⑤⑥B、②④⑤⑥⑦C、①②⑥⑦D、②④⑤⑥
(2)滴定操作时,左手控制酸式滴定管活塞,眼睛注视液滴下滴速度和锥形瓶中溶液颜色的变化;
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤.需过滤的原因是除去BaCO3沉淀,使滤液只含Ba(OH)2,以保证实验成功;
(4)①本实验中,用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液时,由于操作不当,滴定结束后滴定管尖嘴处有一气泡,则实际用去盐酸大于19.60mL(填大于、小于、等于)
②若滴定Ba(OH)2溶液时使用的酸式滴定管未经处理,即换0.01mol•L-1盐酸溶液进行第二次滴定,导致算出空气中CO2值(填偏高、偏低或无影响)偏低.
(5)由实验数据算出空气中CO2的体积分数为0.025%.
2.NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 6.4gCu在足量的硫蒸气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LSO2和SO3的混合物中硫原子数为0.5NA | |
| C. | 1L0.1mol•L-1的NH4Cl溶液中NH4+数目为0.1NA | |
| D. | 通常情况下,3.4gNH3中共用电子对数为0.8NA |
9.如表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体.
(1)a呈深红棕色,a的元素在元素周期表中的位置为第四周期第VIIA族;
(2)写出d的元素原子的最外层电子排布式3s23p2;其元素原子核外中共有5种能量不同的电子;
(3)写出c的气态氢化物的水溶液与b的元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S 2-+H2O.
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
(2)写出d的元素原子的最外层电子排布式3s23p2;其元素原子核外中共有5种能量不同的电子;
(3)写出c的气态氢化物的水溶液与b的元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S 2-+H2O.
9.我国新修订的《环境保护法》已于2015年1月1日起施行.下列有关做法不正确的是( )
| A. | 用CO2合成聚碳酸酯等可降解塑料,以减少白色污染 | |
| B. | 减少生产、生活中产生的扬尘,以减少雾霾天气的形成 | |
| C. | 加强生活污水的脱氮、除磷处理,以遏制水体的富营养化 | |
| D. | 使用汽车尾气净化器.以减少二氧化碳的排放 |
6.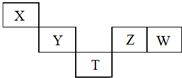 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )| A. | YW4与H2在高温下反应主要生成YH4和HW | |
| B. | X的原子半径比T原子半径小,两者原子序数之差为29 | |
| C. | W氧化物的水化物的酸性一定强于Z的氧化物的水化物 | |
| D. | T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物 |