题目内容
醋酸CH3COOH是一种一元弱酸.
(1)浓度为0.1mol/L醋酸溶液中各离子浓度按照由大到小排序为 .
(2)将浓度均为0.1mol/L的醋酸和醋酸钠溶液等体积混合,溶液显酸性,则混合溶液中各离子浓度按照由大到小排序为 .
(3)向浓度为0.1mol/L的醋酸溶液中加入等浓度的醋酸钠溶液至中性,则混合溶液中各离子浓度按照由大到小排序为 .
(1)浓度为0.1mol/L醋酸溶液中各离子浓度按照由大到小排序为
(2)将浓度均为0.1mol/L的醋酸和醋酸钠溶液等体积混合,溶液显酸性,则混合溶液中各离子浓度按照由大到小排序为
(3)向浓度为0.1mol/L的醋酸溶液中加入等浓度的醋酸钠溶液至中性,则混合溶液中各离子浓度按照由大到小排序为
考点:离子浓度大小的比较,弱电解质在水溶液中的电离平衡
专题:
分析:(1)醋酸为一元弱酸,在溶液中只能部分电离出氢离子,溶液显示酸性,据此判断溶液中离子浓度大小;
(2)醋酸的电离程度大于醋酸根离子水解程度,溶液显示酸性,则c(CH3COO-)>c(Na+)、c(H+)>c(OH-);
(3)溶液为中性,则c(H+)=c(OH-),根据电荷守恒可得:c(CH3COO-)=c(Na+).
(2)醋酸的电离程度大于醋酸根离子水解程度,溶液显示酸性,则c(CH3COO-)>c(Na+)、c(H+)>c(OH-);
(3)溶液为中性,则c(H+)=c(OH-),根据电荷守恒可得:c(CH3COO-)=c(Na+).
解答:
解:(1)浓度为0.1mol/L醋酸溶液中,醋酸在溶液中部分电离出氢离子,醋酸电离的氢离子与醋酸根离子浓度相等,溶液中还存在水电离的氢离子,则:c(H+)>c(CH3COO-),醋酸溶液中各离子浓度按照由大到小排序为:c(H+)>c(CH3COO-)>c(OH-),
故答案为:c(H+)>c(CH3COO-)>c(OH-);
(2)将浓度均为0.1mol/L的醋酸和醋酸钠溶液等体积混合,溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(Na+),混合溶液中各离子浓度按照由大到小排序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(3)向浓度为0.1mol/L的醋酸溶液中加入等浓度的醋酸钠溶液至中性,则c(H+)=c(OH-),根据电荷守恒可得:c(CH3COO-)=c(Na+),则混合溶液中各离子浓度按照由大到小排序为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),
故答案为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-).
故答案为:c(H+)>c(CH3COO-)>c(OH-);
(2)将浓度均为0.1mol/L的醋酸和醋酸钠溶液等体积混合,溶液显酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(Na+),混合溶液中各离子浓度按照由大到小排序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(3)向浓度为0.1mol/L的醋酸溶液中加入等浓度的醋酸钠溶液至中性,则c(H+)=c(OH-),根据电荷守恒可得:c(CH3COO-)=c(Na+),则混合溶液中各离子浓度按照由大到小排序为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),
故答案为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-).
点评:本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握电荷守恒、物料守恒、盐的水解原理及其应用方法,明确判断溶液中离子浓度大小常用方法,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%.维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是( )
| A、6mol C+2mol D |
| B、1mol A+0.5mol B+1.5mol C+0.5mol D |
| C、1mol A+0.5mol B+1.5mol C |
| D、4mol A+2mol B |
Na、Mg、Al各2mol,分别与含1mol HCl的盐酸反应,在相同状况下产生的H2的体积之比为( )
| A、1:1:1 |
| B、1:2:3 |
| C、2:1:1 |
| D、3:2:1 |
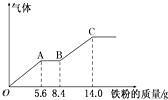 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、原混合酸中HNO3的物质的量为0.1 mol |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、H2SO4浓度为2.5 mol?L-1 |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,1.8 g H2O所含有的质子数为NA |
| B、1 L 1 mol/L的Na2CO3溶液中含有的CO32-数目为NA |
| C、25℃时,1 L pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2NA |
| D、标准状况下,2.24 L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.2NA |
下列溶液,一定呈中性的是( )
| A、由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液 |
| B、c(H+)=1.0×10-7mol?L-1的溶液 |
| C、pH=14-pOH的溶液 |
| D、pH=pOH的溶液 |
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.

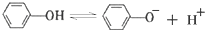 ,苯酚的酸性大于
,苯酚的酸性大于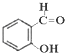 (邻羟基苯甲醛),其原因是
(邻羟基苯甲醛),其原因是