题目内容
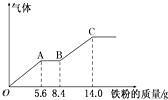 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、原混合酸中HNO3的物质的量为0.1 mol |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、H2SO4浓度为2.5 mol?L-1 |
考点:有关混合物反应的计算
专题:
分析:由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,
A、OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
B.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
C.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;
D.最终溶液为硫酸亚铁,结合消耗铁的总质量计算硫酸的物质的量,进而计算硫酸的浓度.
A、OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,根据铁的物质的量结合离子方程式计算;
B.铁先与硝酸反应生成一氧化氮与铁离子,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应;
C.铁先与硝酸反应,之后铁与铁离子反应生产亚铁离子,最后是铁和硫酸反应,铁单质全部转化为亚铁离子,硝酸全部起氧化剂作用,没有显酸性的硝酸;
D.最终溶液为硫酸亚铁,结合消耗铁的总质量计算硫酸的物质的量,进而计算硫酸的浓度.
解答:
解:A.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,由于原溶液分成2等份进行实验,故原混合液中n(NO3-)=2n(Fe)=2×
=0.2mol,故A错误;
B.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;
C.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;
D.第二份反应消耗22.4g铁,物质的量为
=0.25mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.25mol,所原混合酸中H2SO4物质的量浓度为
=2.5mol/L,故D正确.
故选A.
| 5.6g |
| 56g/mol |
B.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故B正确;
C.硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故C正确;
D.第二份反应消耗22.4g铁,物质的量为
| 14g |
| 56g/mol |
| 0.25mol |
| 0.1L |
故选A.
点评:本题以图象为载体,考查有关金属和酸反应的计算题,难度较大,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
下列说法正确的是( )
| A、化合反应一定是放热反应 |
| B、乙二醇和丙三醇都易溶于水和乙醇 |
| C、牺牲阳极的阴极保护法是利用了电解原理 |
| D、相同条件下,CuSO4溶液比FeCl3溶液使H2O2分解速率更快 |
下列各组物质不用任何外加试剂,只用胶头滴管和试管就能鉴别的是( )
| A、AgNO3溶液和NaCl溶液 |
| B、BaCl2溶液和KHSO4溶液 |
| C、NaHCO3溶液和盐酸 |
| D、Na2CO3溶液和盐酸 |
下列各化合物的命名正确的是( )
| A、CH2=CH-CH=CH2 1,3-二丁烯 |
B、 2-甲基丁烷 2-甲基丁烷 |
C、 苯酚 苯酚 |
D、 间二甲苯 间二甲苯 |
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
| ||
| A、5:3 | B、5:4 |
| C、1:1 | D、3:5 |
下列变化过程中,共价键被破坏的是( )
| A、烧碱固体融化 |
| B、氯化氢气体溶于水 |
| C、干冰气化 |
| D、碘溶于酒精 |
