题目内容
恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)?xC(g)+2D(s),2min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol?L-1.
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 .
(2)x= .
(3)A的转化率与B的转化率之比为 .
(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)A的转化率与B的转化率之比为
考点:化学平衡的计算
专题:
分析:(1)2min达到平衡,C的浓度为1.2mol/L,结合v=
计算;
(2)2min时反应达到平衡状态,此时剩余1.2mol B,计算B的反应速率,反应速率之比等于化学计量数之比;
(3)2A(g)+B(g)
xC(g)+2D(s),
开始 2 2 0 0
转化 1.6 0.8
平衡0.4 1.2
以此计算转化率.
| △c |
| △t |
(2)2min时反应达到平衡状态,此时剩余1.2mol B,计算B的反应速率,反应速率之比等于化学计量数之比;
(3)2A(g)+B(g)
| ||
开始 2 2 0 0
转化 1.6 0.8
平衡0.4 1.2
以此计算转化率.
解答:
解:(1)2min达到平衡,C的浓度为1.2mol/L,由v=
=
=0.6mol/(L.min),故答案为:0.6mol/(L.min);
(2)2min时反应达到平衡状态,此时剩余1.2mol B,则B的反应速率为
=0.2mol/(L.min),由反应速率之比等于化学计量数之比可知,x=3,故答案为:3;
(3)2A(g)+B(g)
xC(g)+2D(s),
开始 2 2 0 0
转化1.6 0.8
平衡0.4 1.2
则A、B的转化率之比为
:0.4=2:1,故答案为:2:1.
| △c |
| △t |
| 1.2mol/L |
| 2min |
(2)2min时反应达到平衡状态,此时剩余1.2mol B,则B的反应速率为
| ||
| 2min |
(3)2A(g)+B(g)
| ||
开始 2 2 0 0
转化1.6 0.8
平衡0.4 1.2
则A、B的转化率之比为
| 1.6 |
| 2 |
点评:本题考查化学平衡的计算、平衡的判定等,注意利用反应速率的关系确定x为解答的关键,注重高考常考考点的考查,题目难度中等.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
除去混在Na2CO3粉末中的少量NaHCO3最合理的方法是( )
| A、加热 |
| B、加NaOH溶液 |
| C、加盐酸 |
| D、加CaCl2溶液 |
头孢羟氨苄(如图)被人体吸收效果良好,疗效明显,且毒性反应极小,因而被广泛适用于敏感细菌所致的尿路感染、皮肤软组织感染以及急性扁桃体炎、急性咽炎、中耳炎和肺部感染等的治疗.已知肽键可以在碱性条件下水解,下列对头孢羟氨苄的说法中正确的是( )
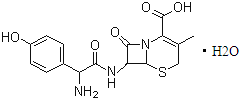

| A、头孢羟氨苄的化学式为C16H16N3O5S?H2O |
| B、1mol头孢羟氨苄与NaOH溶液和浓溴水反应时,分别需要消耗NaOH 4mol和Br2 3mol |
| C、在催化剂存在的条件下,1mol头孢羟氨苄消耗7molH2 |
| D、头孢羟氨苄在空气中能稳定存在 |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)?4NO2 (g)+O2(g)△H>0
t℃时,向密闭容器中通入N2O5,部分实验数据见下表:下列说法中不正确的是( )
t℃时,向密闭容器中通入N2O5,部分实验数据见下表:下列说法中不正确的是( )
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A、500 s 内N2O5分解速率为2.96╳10-3mol?L-1?s-1 |
| B、达平衡时,N2O5的转化率为50% |
| C、达平衡后,升高温度平衡常数减小 |
| D、达平衡后,其他条件不变,将容器的体积压缩到原来的一半,c(N2O5)>5.00 mol?L-1 |
下列说法正确的是( )
| A、化合反应一定是放热反应 |
| B、乙二醇和丙三醇都易溶于水和乙醇 |
| C、牺牲阳极的阴极保护法是利用了电解原理 |
| D、相同条件下,CuSO4溶液比FeCl3溶液使H2O2分解速率更快 |
 某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答:
某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图.依图回答: