题目内容
8.下列化学用语表达正确的是( )| A. | 氮气的电子式  | B. | S2-的结构示意图: | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: |
分析 A.氮原子为成键的孤对电子对未画出;
B.硫离子的质子数为16,最外层满足了8个电子的稳定结构;
C.二氧化碳为直线型结构,分子中存在两个碳氧双键;D.氯化钠为离子化合物,据此书写判断.
解答 解:A.氮原子为成键的孤对电子对未画出,氮气分子电子式为 ,故A错误;
,故A错误;
B.硫离子的质子数为16,则硫离子结构示意图为 ,故B正确;
,故B正确;
C.二氧化碳分子的结构式:O=C=O,故C错误;
D.氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ;故D错误,故选B.
;故D错误,故选B.
点评 本题考查常用化学用语书写,难度不大,注意掌握常用化学用语的书写原则.

练习册系列答案
相关题目
17.化学反应:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1<0
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0
C(s)+O2(g)═CO2(g)△H3<0;
下列说法中不正确的是(相同条件下)( )
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0
C(s)+O2(g)═CO2(g)△H3<0;
下列说法中不正确的是(相同条件下)( )
| A. | 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 | |
| B. | 12 g C所具有的能量一定大于28 g CO所具有的能量 | |
| C. | △H1+△H2=△H3 | |
| D. | 将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
18.下表中的数据表示破坏1mol化学键需消耗的能量:根据下表数据计算以下反应生成1mol CO2时的热量变化( )
CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(g)
CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(g)
| 化 学 键 | C-H | O-O | O=O | C-O | C=O | H-O |
| 能量 (kJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800 kJ | B. | 放出热量1520 kJ | C. | 吸收热量110 kJ | D. | 放出热量610 kJ |
 、⑨
、⑨ 、⑩
、⑩
 .
.
 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.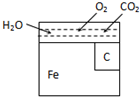 金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.
金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.