题目内容
18.下表中的数据表示破坏1mol化学键需消耗的能量:根据下表数据计算以下反应生成1mol CO2时的热量变化( )CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(g)
| 化 学 键 | C-H | O-O | O=O | C-O | C=O | H-O |
| 能量 (kJ) | 415 | 138 | 498 | 343 | 798 | 465 |
| A. | 放出热量800 kJ | B. | 放出热量1520 kJ | C. | 吸收热量110 kJ | D. | 放出热量610 kJ |
分析 依据化学反应的焓变=反应物总键能-生成物总键能计算得到反应的焓变.
解答 解:化学反应的焓变=反应物总键能-生成物总键能,CH4(g)+2O2(g)$\frac{\underline{\;点燃\;}}{\;}$CO2(g)+2H2O(g)△H=(4×415KJ/mol+2×498KJ/mol)-(2×798KJ/mol+4×465KJ/mol)=-800KJ/mol;
故选:A.
点评 本题考查反应热与键能的关系,化学反应的焓变=反应物总键能-生成物总键能,题目难度不大.

练习册系列答案
相关题目
8.下列化学用语表达正确的是( )
| A. | 氮气的电子式  | B. | S2-的结构示意图: | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: |
9.下列关于元素周期表的叙述正确的是( )
| A. | 元素周期表中共有18个纵行,18个族,其中主族数为7个 | |
| B. | 周期表中,元素族序数等于该族元素原子的最外层电子数 | |
| C. | 周期表中,第四周期有32种元素,包括镧系元素 | |
| D. | 周期表中,ⅠA族对应第1纵行,只有一种非金属元素 |
6.下列关于金属材料的说法正确的是( )
| A. | 氧化铝属于合金的一种,有着广泛的用途 | |
| B. | 切过肉的菜刀比切过蔬菜的菜刀更耐腐蚀 | |
| C. | 铁是地壳中含量最高的金属,也是世界上年产量最高的金属 | |
| D. | 制作沉重的机床底座时应努力实现用纯铁替代钢 |
13.化学与生活、生产密切相关.下列情况会对人体健康造成较大危害的是( )
| A. | 用漂白粉给游泳池消毒杀菌 | |
| B. | 用SO2熏制食品 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢 | |
| D. | 用小苏打发酵面团制作馒头 |
3. 有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )
有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )
 有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )
有A、B、C、D四种短周期元素,它们在周期表中的位置如图所示,已知四种元素核外共有56个电子,则以下说法不正确的是( )| A. | A的氢化物在常温下通常为液态 | |
| B. | A的单质与C的某种化合物之间可能发生置换反应 | |
| C. | B、C、D的含氧酸酸性依次增强 | |
| D. | D的单质是制备漂白剂的重要原料 |
10.下列离子方程式与所述事实相符且正确的是( )
| A. | 磁性氧化铁溶于足量稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3(胶体)+CO32- | |
| D. | 氯气与水反应:Cl2+H2O=2H++ClO-+Cl- |
7.某溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、Fe2+、NO3-、Cl-、SO42-中若干种组成,现将溶液分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成.则溶液中一定含有的离子有( )
| A. | Al3+、NO3- | B. | Ba2+、Al3+、Cl- | C. | Ba2+、Al3+、NO3- | D. | Ag+、Al3+、NO3- |
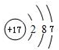 ,写出化合物E2B2的电子式
,写出化合物E2B2的电子式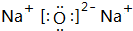 ,C在周期表中的位置第三周期VIA族.
,C在周期表中的位置第三周期VIA族.