题目内容
18.下列叙述错误的是( )①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③NH3D+ 中质子数,电子数,中子数分别为 11,10,8
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥第三周期元素原子形成的简单阳离子中,Al3+的半径最小
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键.
| A. | ②③④⑥ | B. | ①⑤⑥ | C. | ②③④ | D. | ①⑤⑦ |
分析 ①元素的非金属性越强,对应的氢化物越稳定;
②金属晶体中原子半径越小,金属阳离子的电荷越多,金属单质的熔点越高;
③H没有中子,D含有1个中子;
④副族与第VIII族元素全部为金属元素;
⑤多电子原子中,在离核较近的区域内运动的电子能量较低;
⑥电子数相同的阳离子,原子序数越大,阳离子半径越小;
⑦两个非金属原子间以共用电子对成键,金属元素和非金属元素的原子间可能形成共价键.
解答 解:①非金属性F>O>S,元素的非金属性越强,对应的氢化物越稳定,所以稳定性:HF>H2O>H2S,故①错误;
②金属晶体中原子半径越小,金属阳离子的电荷越多,金属单质的熔点越高,原子半径:Al<Na<K,所以熔点:Al>Na>K,故②正确;
③H没有中子,D含有1个中子,所以NH3D+ 中质子数,电子数,中子数分别为 11,10,8,故③正确;
④元素周期表中从ⅢB族到ⅡB族10个纵行,包含副族与第VIII族元素,全部为金属元素,故④正确;
⑤多电子原子中,在离核较近的区域内运动的电子能量较低,离核较远的区域内运动的电子能量较高,故⑤错误;
⑥电子数相同的阳离子,原子序数越大,阳离子半径越小,所以第三周期元素原子形成的简单阳离子中,Al3+的半径最小,故⑥正确;
⑦两个非金属原子间以共用电子对成键,则两个非金属元素原子间只可能形成共价键,金属元素和非金属元素的原子间可能形成共价键,如氯化铝,故⑦错误.
故选A.
点评 本题考查元素周期律、化学键等,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
相关题目
12.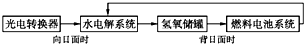 如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
 如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )
如图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )| A. | 该能量转化系统工作时,需不断补充H2O | |
| B. | 该转化系统的能量本质上来源于太阳能 | |
| C. | 水电解系统中的阴极反应:O2+2H2O+4e-═4OH- | |
| D. | 燃料电池放电时的负极反应:H2-2e-═2H+ |
6.a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.下列叙述错误的是( )
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与其他元素生成的化合物都是离子化合物 | |
| D. | a.b.c.d与氢形成的化合物中化学键均为极性共价键 |
13.下列叙述错误的是( )
| A. | ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| D. | 两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键 |
3.某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为2Ag++O2+2SO32-=Ag2SO4↓+SO42-.
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是证明X不是Ag2O.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
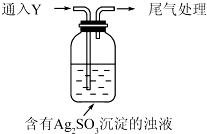
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O$\frac{\underline{\;H+\;}}{\;}$2Ag+H2SO4.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为2Ag++O2+2SO32-=Ag2SO4↓+SO42-.
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是证明X不是Ag2O.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O$\frac{\underline{\;H+\;}}{\;}$2Ag+H2SO4.

10.下列说法中错误的是( )
| A. | KAl(SO4)2•12H2O不属于配合物 | |
| B. | 配位化合物中的配体可以是分子也可以是阴离子 | |
| C. | 配位数为4的配合物均为正四面体结构 | |
| D. | 已知[Cu(NH3)2]2+的空间构型为直线型,则它的中心原子采用sp杂化 |
7.下列电子式正确的是( )
| A. |  | B. |  | C. |  | D. |  |
8.下列化学用语表达正确的是( )
| A. | 氮气的电子式  | B. | S2-的结构示意图: | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: |