题目内容
17.化学反应:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1<0CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2<0
C(s)+O2(g)═CO2(g)△H3<0;
下列说法中不正确的是(相同条件下)( )
| A. | 56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 | |
| B. | 12 g C所具有的能量一定大于28 g CO所具有的能量 | |
| C. | △H1+△H2=△H3 | |
| D. | 将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
分析 A、反应是放热反应,依据能量守恒分析判断;
B、断裂化学键吸收能量,生成化学键放出能量;
C、根据盖斯定律分析;
D、△H3和△H1为负值,放热多则△H小.
解答 解:A、反应是放热反应,反应物的总能量大于生成物的总能量,所以56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量,故A正确;
B、断裂化学键吸收能量,生成化学键放出能量,已知C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1<0为放热反应,△H=反应物的键能之和-产物键能之和<0,所以反应物的键能之和小于产物键能之和,但反应物不仅是C,还有O2,故B错误;
C、依据热化学方程式和盖斯定律计算分析,反应焓变与反应过程无关,与起始和终了状态有关,所以△H1+△H2=△H3,故C正确;
D、生成CO2的反应热为△H3,生成CO的反应热为△H1,因为△H1+△H2=△H3,所以生成CO2的反应比生成CO的反应放出的热量多,故D正确.
故选:B.
点评 本题考查了化学反应的能量变化,能量守恒和断裂化学键吸收能量,形成化学键放出能量是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列电子式正确的是( )
| A. |  | B. |  | C. |  | D. |  |
8.下列化学用语表达正确的是( )
| A. | 氮气的电子式  | B. | S2-的结构示意图: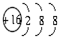 | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: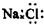 |
5.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图 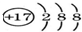 | |
| B. | 溴化钠的电子式: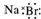 | |
| C. | 氯化镁的电子式: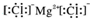 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
12.对于实验Ⅰ~Ⅳ的实验现象预测正确的是( )

| A. | 实验I:试管中先出现白色胶状物质,后溶解 | |
| B. | 实验II:振荡后静置,下层溶液颜色保持不变 | |
| C. | 实验III:抽去中间玻璃片,瓶内产生白烟 | |
| D. | 实验IV:酸性KMnO4溶液中出现气泡,颜色无变化 |
2.化学家们合成了如图所示的一系列星烷,如三星烷、四星烷、五星烷等.下列说法不正确的是( )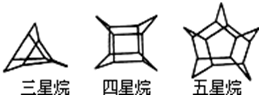

| A. | 三星烷与丙苯互为同分异构体 | B. | 五星烷的二氯取代物有8种 | ||
| C. | 六星烷的化学式为C18H24 | D. | 七星烷的一硝基取代物有2种 |
9.下列关于元素周期表的叙述正确的是( )
| A. | 元素周期表中共有18个纵行,18个族,其中主族数为7个 | |
| B. | 周期表中,元素族序数等于该族元素原子的最外层电子数 | |
| C. | 周期表中,第四周期有32种元素,包括镧系元素 | |
| D. | 周期表中,ⅠA族对应第1纵行,只有一种非金属元素 |
6.下列关于金属材料的说法正确的是( )
| A. | 氧化铝属于合金的一种,有着广泛的用途 | |
| B. | 切过肉的菜刀比切过蔬菜的菜刀更耐腐蚀 | |
| C. | 铁是地壳中含量最高的金属,也是世界上年产量最高的金属 | |
| D. | 制作沉重的机床底座时应努力实现用纯铁替代钢 |
7.某溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、Fe2+、NO3-、Cl-、SO42-中若干种组成,现将溶液分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成.则溶液中一定含有的离子有( )
| A. | Al3+、NO3- | B. | Ba2+、Al3+、Cl- | C. | Ba2+、Al3+、NO3- | D. | Ag+、Al3+、NO3- |