题目内容
20.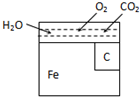 金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.
金属材料在使用的过程中,由于长期暴露在空气中,会因为氧化而逐渐腐蚀.其中电化学腐蚀是金属的主要形式.右图是钢铁在空气中发生电化学腐蚀的简单图示.试分析下列问题:钢铁发生电化腐蚀时,可以形成原电池.(1)该原电池的负极为铁,负极发生的电极反应为Fe-2e-=Fe2+;
(2)正极得到电子的物质是O2,正极发生的电极反应为O2+2H2O+4e-=4OH-.
分析 钢铁发生电化学腐蚀时,可以形成原电池,负极上Fe失去电子,正极上氧气得到电子,生成氢氧根,据此分析.
解答 解:(1)钢铁发生电化学腐蚀时,负极上Fe失去电子,负极反应为Fe-2e-=Fe2+,故答案为:铁;Fe-2e-=Fe2+;
(2)由于水膜呈弱酸性,故钢铁发生的是吸氧腐蚀,即正极上氧气得到电子,电极反应为O2+2H2O+4e-=4OH-,故答案为:O2;O2+2H2O+4e-=4OH-;
点评 本题考查电化学腐蚀,为高频考点,把握电化学腐蚀中的电解质对析氢腐蚀和吸氧腐蚀的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
10.下列说法中错误的是( )
| A. | KAl(SO4)2•12H2O不属于配合物 | |
| B. | 配位化合物中的配体可以是分子也可以是阴离子 | |
| C. | 配位数为4的配合物均为正四面体结构 | |
| D. | 已知[Cu(NH3)2]2+的空间构型为直线型,则它的中心原子采用sp杂化 |
11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | pH=1的溶液中:Fe2+、NO3-、AlO2-、Na+ | |
| C. | 水电离出的c(H+)=10-12 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
8.下列化学用语表达正确的是( )
| A. | 氮气的电子式  | B. | S2-的结构示意图: | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: |
15.下列物质中,既含有离子键,又含有共价键的是( )
| A. | H2O | B. | CaCl2 | C. | CaO2 | D. | Cl2 |
5.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图  | |
| B. | 溴化钠的电子式: | |
| C. | 氯化镁的电子式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
12.对于实验Ⅰ~Ⅳ的实验现象预测正确的是( )

| A. | 实验I:试管中先出现白色胶状物质,后溶解 | |
| B. | 实验II:振荡后静置,下层溶液颜色保持不变 | |
| C. | 实验III:抽去中间玻璃片,瓶内产生白烟 | |
| D. | 实验IV:酸性KMnO4溶液中出现气泡,颜色无变化 |
9.下列关于元素周期表的叙述正确的是( )
| A. | 元素周期表中共有18个纵行,18个族,其中主族数为7个 | |
| B. | 周期表中,元素族序数等于该族元素原子的最外层电子数 | |
| C. | 周期表中,第四周期有32种元素,包括镧系元素 | |
| D. | 周期表中,ⅠA族对应第1纵行,只有一种非金属元素 |
10.下列离子方程式与所述事实相符且正确的是( )
| A. | 磁性氧化铁溶于足量稀硝酸:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3(胶体)+CO32- | |
| D. | 氯气与水反应:Cl2+H2O=2H++ClO-+Cl- |