题目内容
3.下表是元素同期表的一部分,表中每一序号分别代表一种元素.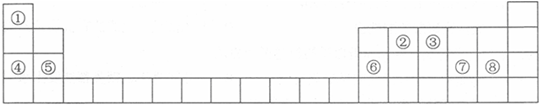
(1)元素③位于周期表第2周期VA族;
(2)②、⑦、⑧非金属性最强的元素,其最高价氧化物是Cl2O7(填化学式).
(3)元素⑤、⑥、⑦简单离子的半径由大到小的顺序为S2->Mg2+>Al3+(用化学符号表示);
(4)由①和⑦两种元素形成的化合物中,含有的化学键是极性共价键(填“极性共价键”或“非极性共价键”).
(5)只含有元素①、③、⑧的一种常见的盐的化学式是NH4Cl.
分析 由元素在周期表中的位置可知,①为H、②为C、③为N、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl.
(1)元素③位于第2周期VA族;
(2)②、⑦、⑧非金属性最强的元素为Cl,其最高价为+7价;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径比较越大;
(4)由①和⑦两种元素形成的化合物为H2S;
(5)只含有元素H、N、Cl的一种常见的盐为氯化铵.
解答 解:由元素在周期表中的位置可知,①为H、②为C、③为N、④为Na、⑤为Mg、⑥为Al、⑦为S、⑧为Cl.
(1)由元素位置可知,元素③位于第2周期VA族,故答案为:第2周期VA族;
(2)②、⑦、⑧非金属性最强的元素为Cl,其最高价为+7价,最高价氧化物是Cl2O7,故答案为:Cl2O7;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径比较越大,故离子半径:S2->Mg2+>Al3+,故答案为:S2->Mg2+>Al3+;
(4)由①和⑦两种元素形成的化合物为H2S,含有的化学键为极性共价键,故答案为:极性共价键;
(5)只含有元素H、N、Cl的一种常见的盐为为NH4Cl,故答案为:NH4Cl.
点评 本题考查元素周期表与元素周期律,比较基础,熟练掌握元素周期表结构,会进行微粒半径比较,注意对基础知识的掌握.

练习册系列答案
相关题目
13.下列叙述错误的是( )
| A. | ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| D. | 两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键 |
14.制造玻璃的主要原料( )
| A. | 烧碱 石灰石 石英 | B. | 纯碱 石灰石 石英 | ||
| C. | 纯碱 生石灰 石英 | D. | 纯碱 熟石灰 石英 |
11.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | pH=1的溶液中:Fe2+、NO3-、AlO2-、Na+ | |
| C. | 水电离出的c(H+)=10-12 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
8.下列化学用语表达正确的是( )
| A. | 氮气的电子式  | B. | S2-的结构示意图: | ||
| C. | 二氧化碳分子的结构式为 O-C-O | D. | NaCl的电子式: |
15.下列物质中,既含有离子键,又含有共价键的是( )
| A. | H2O | B. | CaCl2 | C. | CaO2 | D. | Cl2 |
12.对于实验Ⅰ~Ⅳ的实验现象预测正确的是( )

| A. | 实验I:试管中先出现白色胶状物质,后溶解 | |
| B. | 实验II:振荡后静置,下层溶液颜色保持不变 | |
| C. | 实验III:抽去中间玻璃片,瓶内产生白烟 | |
| D. | 实验IV:酸性KMnO4溶液中出现气泡,颜色无变化 |
13.化学与生活、生产密切相关.下列情况会对人体健康造成较大危害的是( )
| A. | 用漂白粉给游泳池消毒杀菌 | |
| B. | 用SO2熏制食品 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢 | |
| D. | 用小苏打发酵面团制作馒头 |