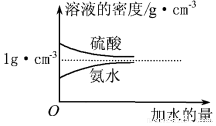
题目内容
4.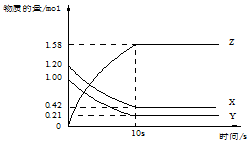 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应的化学方程式为:X(g)+Y(g)?Z(g) | |
| D. | 反应开始到10s时,Y的转化率为79.0% |
分析 根据图象知,随着反应的进行,X、Y的物质的量减小,Z的物质的量增加,说明X、Y是反应物,Z是生成物,达到平衡时△n(X)=(1.20-0.41)mol=0.79mol,△n(Y)=(1.00-0.21)mol=0.79mol,△n(Z)=(1.58-0)mol=1.58mol,同一反应中同一时间段内各物质的物质的量变化之比等于其计量数之比,所以
X、Y、Z的计量数之比=1:1:1,则该反应方程式为X(g)+Y(g)?2Z(g),
A.反应开始到10s,用Z表示的反应速率=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$;
B.反应开始到10s,X的物质的量浓度减少了 $\frac{0.79mol}{2L}$;
C.同一反应方程式中同一时间段内各物质的物质的量变化之比等于其计量数之比;
D.反应开始到10s时,Y转化了(1.00-0.21)mol.
解答 解:根据图象知,随着反应的进行,X、Y的物质的量减小,Z的物质的量增加,说明X、Y是反应物,Z是生成物,达到平衡时△n(X)=(1.20-0.41)mol=0.79mol,△n(Y)=(1.00-0.21)mol=0.79mol,△n(Z)=(1.58-0)mol=1.58mol,同一反应中同一时间段内各物质的物质的量变化之比等于其计量数之比,所以
X、Y、Z的计量数之比=1:1:1,则该反应方程式为X(g)+Y(g)?2Z(g),
A.反应开始到10s,用Z表示的反应速率=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.58mol}{2L}}{10s}$=0.079mol/(L•s),故A错误;
B.反应开始到10s,X的物质的量浓度减少了 $\frac{0.79mol}{2L}$=0.395mol/L,故B错误;
C.通过以上分析知,该反应方程式为X(g)+Y(g)?2Z(g),故C错误;
D.反应开始到10s时,Y转化了(1.00-0.21)mol=0.79mol,故D正确;
故选D.
点评 本题考查图象分析,涉及方程式的确定、物质的量及物质的量浓度和反应速率的计算,熟练掌握基本公式及方程式中物质的量变化量与计量数的关系,题目难度不大.

(1)工业上一般采用CO和H2反应合成可再生能源甲醇.反应如下:CO(g)+2H2(g)?CH3OH(g)△H=-90.1KJ•mol-1在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如表所示:(前6min没有改变条件)
| 2min | 4min | 6nin | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②250℃时该反应的平衡常数K的计算式为:$\frac{0.04}{0.06×0.1{2}^{2}}$ (不必化简).
③若6min~8min只改变了某一条件,所改变的具体条件是加1 mol氢气.
④第8min时,该反应是不是达到平衡状态不是.(填“是”或“不是”)
(2)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2.已知:

H2还原NO生成氮气和水蒸气的热化学方程式是2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
| A. | N2的电子式: | B. | S2-的结构示意图: | ||
| C. | HF的电子式: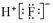 | D. | 肼(N2H4)的结构简式:H2N-NH2 |
| A. | CuCl2 | B. | CuO | C. | FeCl2 | D. | HCl |
| A. | 高温下用焦炭还原SiO2制取粗硅 | |
| B. | 晶体硅熔点高硬度大,因此可用于制作半导体材料 | |
| C. | 石英只能用于生产光导纤维 | |
| D. | 玻璃容器可长期盛放各种酸 |
| A. | RCl | B. | RCl2 | C. | RCl3 | D. | RCl4 |