题目内容
15.下列有关化学用语表示正确的是( )| A. | N2的电子式: | B. | S2-的结构示意图: | ||
| C. | HF的电子式: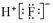 | D. | 肼(N2H4)的结构简式:H2N-NH2 |
分析 A.漏掉了N原子的最外层1对未成键电子对;
B.硫离子的最外层电子数为8,;
C.氟化氢为共价化合物,分子中不存在阴阳离子;
D.肼是氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键.
解答 解:A.氮气分子中存在氮氮三键,N原子最外层达到8电子稳定结构,其电子式为 ,故A错误;
,故A错误;
B.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为: ,故B错误;
,故B错误;
C.HF为共价化合物,分子中存在1个F-H键,氟化氢的电子式为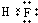 ,故C错误;
,故C错误;
D.肼的分子式为N2H4,其结构简式为:H2N-NH2,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、离子结构示意图、结构简式等知识,明确常见化学用语的表示方法为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
6. 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H 1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H 2
①表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
由表中数据判断△H1<0 (填“>”、“=”或“<”).
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ•mol-1
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
①该电池正极的电极反应为O2+2H2O+4e-=4OH-
②该电池总反应的离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O
③工作一段时间后,测得溶液的pH减小(填“增大”、“减小”或“不变”).
 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H 1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H 2
①表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ•mol-1
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
①该电池正极的电极反应为O2+2H2O+4e-=4OH-
②该电池总反应的离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O
③工作一段时间后,测得溶液的pH减小(填“增大”、“减小”或“不变”).
10.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | △H>0表示产物的总能量低于反应物的总能量 | |
| C. | △H 的单位kJ•mol-1,热量Q的单位为kJ | |
| D. | 化学键断裂过程中释放能量 |
7.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB- HB-?H++B2-.在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是( )
| A. | c(B2-)+c(HB-)=0.1 mol/L | B. | c(B2-)+c(HB-)+c(H2B)=0.1 mol/L | ||
| C. | c(OH-)=c(H+)+c(HB-)+2c(H2B) | D. | c(Na+)+c(OH-)=c(H+)+c(HB-) |
4.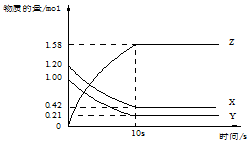 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应的化学方程式为:X(g)+Y(g)?Z(g) | |
| D. | 反应开始到10s时,Y的转化率为79.0% |
5.下列分子的立体构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH3═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4 ⑦HCHO.
①BF3 ②CH3═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4 ⑦HCHO.
| A. | ①②③⑦ | B. | ①⑤⑥ | C. | ②③④⑦ | D. | ③⑤⑥ |
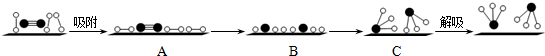
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示: