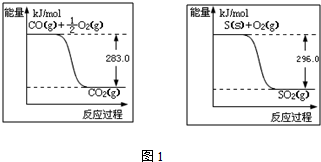
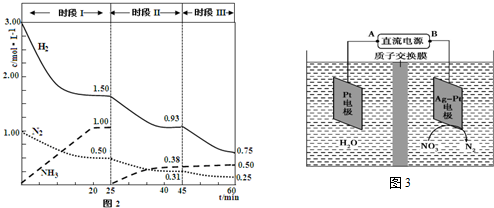
题目内容
12.(1)标况下,等质量的氧气与臭氧的体积之比为3:2,氧原子个数之比1;1.
(2)某金属氯化物 MClx 的摩尔质量为 133.5g/mol,取该金属氯化物 26.7g 配成水溶液,与足量 AgNO3溶液完 全反应,生成 86.1g 白色沉淀.则金属 M 的摩尔质量为27g/mol.
(3)已知硫酸、氨水的密度与所加水量的关系如右图所示,物质的量浓度为 c1mol/L,质量分数为 w1 的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的质量分数大于w1/2 (填“大于”、“小于”或“等于”,下同);质量分数为 w2的氨水(密度为 ρ2 g/cm3)与 w2/5 的氨水等质量混合,所得溶液 的密度大于ρ2 g/cm3.
分析 (1)根据n=$\frac{m}{M}$计算氧气和臭氧的物质的量之比,结合分子构成计算所含氧原子个数;
(2)根据氯元素守恒结合AgCl的量计算氯离子的物质的量,根据公式m=nM来计算即可;
(3)根据稀释定律,稀释前后溶质硫酸的物质的量和质量不变,据此计算稀释后溶液的质量分数;质量分数为w2的氨水与$\frac{{w}_{2}}{5}$的氨水等质量混合,混合后溶液的浓度小于w2,由图可知,氨水的浓度越大密度越小,据此判断混合后溶液的密度与ρ2 g•cm-3关系.
解答 解:(1)根据n=$\frac{m}{M}$知,等质量的氧气(O2)和臭氧(O3),其物质的量之比等于其摩尔质量的反比=48g/mol:32g/mol=3:2,
一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以所含氧原子的个数之比=(3×2):(2×3)=1:1,
故答案为:3:2;1:1;
(2)金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g即$\frac{86.1g}{143.5g/mol}$=0.6molAgCl白色沉淀,所以氯离子的物质的量是0.6mol,金属氯化物MClx的摩尔质量为133.5g/mol,该金属氯化物质量是26.7g,则$\frac{26.7g}{133.5g/mol}$,解得:x=3,所以金属M的摩尔质量为:133.5g/mol-(35.5g/mol×3)=27g/mol,
故答案为:27g/mol;
(3)质量分数为w1的硫酸与水等体积混合,水的质量小于硫酸溶液的质量,故总质量小于原质量的2倍,故质量分数大于w1/2;
质量分数为w2的氨水与$\frac{{w}_{2}}{5}$的氨水等质量混合,混合后溶液的浓度小于w2,由图可知,氨水的浓度越大密度越小,故混合后溶液的密度大于ρ2 g•cm-3,
故答案为:大于;大于.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度等物理量之间的关系为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | c(B2-)+c(HB-)=0.1 mol/L | B. | c(B2-)+c(HB-)+c(H2B)=0.1 mol/L | ||
| C. | c(OH-)=c(H+)+c(HB-)+2c(H2B) | D. | c(Na+)+c(OH-)=c(H+)+c(HB-) |
Ⅰ、从海水中获取的粗盐除了含有泥沙外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质,精制时所用试剂为:A、盐酸;B、BaCl2溶液;C、NaOH溶液;D、Na2CO3溶液.加入试剂的顺序为BCDA或CBDA
Ⅱ、“mol”化学协会高二年级的同学设计了以下实验从海带中提取碘:
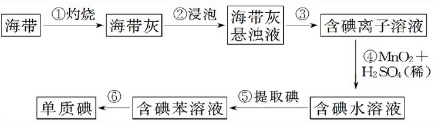
(1)、步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是BDF(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)、步骤③的实验操作名称是过滤;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是萃取分液.
已知:
| 密度(g/cm3) | 熔点(.C) | 沸点(.C) | |
| 碘 | 4.93 | 113.5 | 184.35 |
| 苯 | 0.885 | 80.10 | 5.53 |
Ⅲ、湄潭自来水公司常用Cl2对自来水进行杀菌消毒,试设计实验检验自来水中是否含有Cl-取少量水样,加入硝酸银溶液,若生成白色沉淀,加稀硝酸沉淀不溶解,说明含有氯离子,则证明是Cl2对自来水进行杀菌消毒.
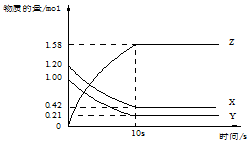 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应的化学方程式为:X(g)+Y(g)?Z(g) | |
| D. | 反应开始到10s时,Y的转化率为79.0% |
| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有 H+ | |
| D. | 新制的氯水能使红色布条褪色,说明氯水中含有Cl2 |