题目内容
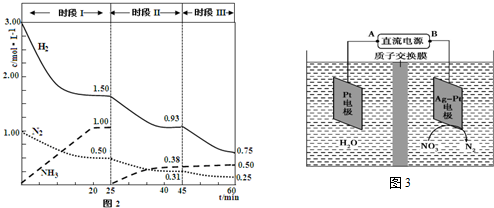
14.氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用.(1)工业上一般采用CO和H2反应合成可再生能源甲醇.反应如下:CO(g)+2H2(g)?CH3OH(g)△H=-90.1KJ•mol-1在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如表所示:(前6min没有改变条件)
| 2min | 4min | 6nin | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②250℃时该反应的平衡常数K的计算式为:$\frac{0.04}{0.06×0.1{2}^{2}}$ (不必化简).
③若6min~8min只改变了某一条件,所改变的具体条件是加1 mol氢气.
④第8min时,该反应是不是达到平衡状态不是.(填“是”或“不是”)
(2)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2.已知:

H2还原NO生成氮气和水蒸气的热化学方程式是2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
分析 (1)①根据表中2min和4min时各种物质的浓度的变化量,结合转化量之比等于方程式计量系数之比可计算出x;
②该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$,将在250℃下,将4min时各物质平衡浓度带入计算;
③根据6min到8min时各物质浓度的变化来确定改变条件;
④求出第8min时反应的浓度商Qc,与250℃时K做比较,若Qc=K反应达到平衡状态;
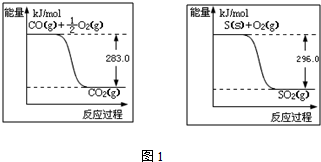
(2)根据能量变化图,则反应断键共吸收2×630+2×436=2132kJ,形成共放出945+4×463=2797kJ,所以该反应共放出2797-2132=665kJ的热量,据此写出H2还原NO生成氮气和水蒸气的热化学方程式.
解答 解:(1)①从图中可知,从2min到4min时各物质的浓度变化之比=△c(CO):△c(H2):△c(CH3OH)=(0.07-0.06):(x-0.12):(0.04-0.03),
化学反应中各物质的转化量之比等于方程式的计量系数得:(0.07-0.06):(x-0.12):(0.04-0.03)=1:2:1,解得:x=0.14,
故答案为:0.14;
②250℃下,甲醇的平衡浓度是0.06mol/L,氢气的平衡浓度是0.12mol/L,一氧化碳的平衡浓度是0.04mol/L,所以平衡常数为:K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.04}{0.06×0.1{2}^{2}}$,
故答案为:$\frac{0.04}{0.06×0.1{2}^{2}}$;
③对比6min和8min时各物质的浓度可知改变条件后反应反应向正方向进行,按照转化量之比等于计量系数之比△C(CO):△C(H2):△C(CH3OH)=0.01mol/L:0.02mol/L:0.01mol/L,所以8min后三种物质的浓度应为:(0.06-0.01)mol/L、(0.12-0.02)mol/L、(0.04+0.01)mol/L,而8min后氢气的浓度为0.2mol/L,所以多加了0.1mol/L×10=1mol的氢气;
故答案为:加1 mol氢气;
④第8min时反应的浓度商为:Qc=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.05}{0.05×0.22}$=$\frac{1}{0.04}$≠K,所以此时没有达到平衡状态,
故答案为:不是;
(2)根据能量变化图可知,则反应断键共吸收2×630+2×436=2132kJ,形成共放出945+4×463=2797kJ,所以该反应共放出2797-2132=665kJ的热量,则H2还原NO生成氮气和水蒸气的热化学方程式是:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1,
故答案为:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJ•mol-1.
点评 本题考查较为综合,题目难度中等,涉及化学平衡移动的影响因素、化学平衡常数的计算和应用和盖斯定律求反应热,题目综合性强,充分考查了学生的分析、理解能力及化学计算能力.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 1:4 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H 1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H 2
①表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-442.8kJ•mol-1
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
①该电池正极的电极反应为O2+2H2O+4e-=4OH-
②该电池总反应的离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O
③工作一段时间后,测得溶液的pH减小(填“增大”、“减小”或“不变”).
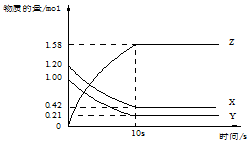 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应的化学方程式为:X(g)+Y(g)?Z(g) | |
| D. | 反应开始到10s时,Y的转化率为79.0% |
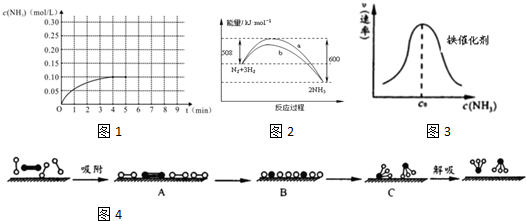
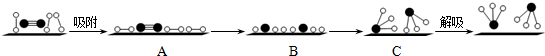
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图4表示: