题目内容
9.下列说法中正确的是( )| A. | 高温下用焦炭还原SiO2制取粗硅 | |
| B. | 晶体硅熔点高硬度大,因此可用于制作半导体材料 | |
| C. | 石英只能用于生产光导纤维 | |
| D. | 玻璃容器可长期盛放各种酸 |
分析 A、工业上可用碳在高温下还原二氧化硅的方法制取少量粗硅:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
B、硅元素位于金属和非金属元素之间,是良好的半导体材料;
C、石英的主要成分是二氧化硅;
D、氢氟酸与二氧化硅反应生成四氟化硅.
解答 解:A、工业上可用碳在高温下还原二氧化硅的方法制取少量粗硅:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,所以高温下用焦炭还原SiO2制取粗硅,故A正确;
B、晶体硅可用于制作半导体材料,是因为其导电性介于导体与绝缘体之间,与熔点高硬度大无关,故B错误;
C、石英的主要成分是二氧化硅,纯净的二氧化硅用于生产光导纤维,结晶的二氧化硅(如水晶、玛瑙等)用作饰物,故C错误;
D、氢氟酸与二氧化硅反应生成四氟化硅,所以玻璃容器并不是可长期盛放各种酸,如氢氟酸,故D错误;
故选A.
点评 本题考查硅及二氧化硅,明确物质的性质是解本题关键,知道硅、二氧化硅的用途,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.水是自然界非常宝贵的自然资源,地球上的水绝大部分是海水,可供人类利用的淡水却是非常有限的.
Ⅰ、从海水中获取的粗盐除了含有泥沙外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质,精制时所用试剂为:A、盐酸;B、BaCl2溶液;C、NaOH溶液;D、Na2CO3溶液.加入试剂的顺序为BCDA或CBDA
Ⅱ、“mol”化学协会高二年级的同学设计了以下实验从海带中提取碘: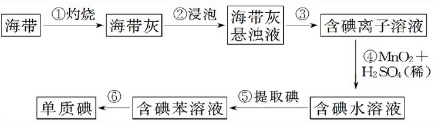
(1)、步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是BDF(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)、步骤③的实验操作名称是过滤;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是萃取分液.
已知:
(3)、步骤⑤中,某同学选用苯来提取碘的理由是苯密度小于水与水互不相溶 碘在苯中的溶解度比在水中大.
Ⅲ、湄潭自来水公司常用Cl2对自来水进行杀菌消毒,试设计实验检验自来水中是否含有Cl-取少量水样,加入硝酸银溶液,若生成白色沉淀,加稀硝酸沉淀不溶解,说明含有氯离子,则证明是Cl2对自来水进行杀菌消毒.
Ⅰ、从海水中获取的粗盐除了含有泥沙外,还含有MgCl2、CaCl2、Na2SO4等可溶性杂质,精制时所用试剂为:A、盐酸;B、BaCl2溶液;C、NaOH溶液;D、Na2CO3溶液.加入试剂的顺序为BCDA或CBDA
Ⅱ、“mol”化学协会高二年级的同学设计了以下实验从海带中提取碘:

(1)、步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是BDF(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)、步骤③的实验操作名称是过滤;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是萃取分液.
已知:
| 密度(g/cm3) | 熔点(.C) | 沸点(.C) | |
| 碘 | 4.93 | 113.5 | 184.35 |
| 苯 | 0.885 | 80.10 | 5.53 |
Ⅲ、湄潭自来水公司常用Cl2对自来水进行杀菌消毒,试设计实验检验自来水中是否含有Cl-取少量水样,加入硝酸银溶液,若生成白色沉淀,加稀硝酸沉淀不溶解,说明含有氯离子,则证明是Cl2对自来水进行杀菌消毒.
4.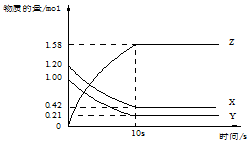 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应的化学方程式为:X(g)+Y(g)?Z(g) | |
| D. | 反应开始到10s时,Y的转化率为79.0% |
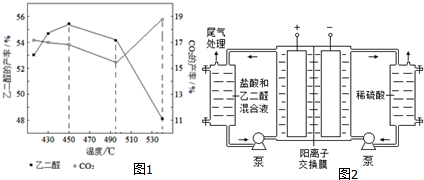
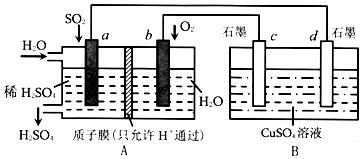
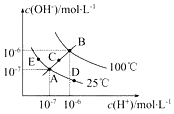 已知水的电离平衡曲线如图示,试回答下列问题:
已知水的电离平衡曲线如图示,试回答下列问题: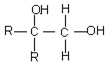 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$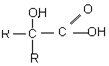

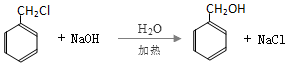 ;
;