题目内容
13.次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:(1)H3PO2是一元中强酸,写出其电离方程式:H3PO2?H2PO2-+H+
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①利用H3PO2进行镀银反应,氧化剂与还原剂的物质的量之比为4:1,氧化产物为H3PO4.
②NaH2PO2为正盐(填“正盐”或“酸式盐”),其溶液显弱碱性(填“弱酸性”、“中性”或“弱碱性”).
(3)H3PO2的工业制法是:
将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与氢氧化钡溶液反应的化学方程式:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑.
分析 (1)根据H3PO2是一元中强酸可知,H3PO2是弱电解质,溶液中部分电离出氢离子,据此写出电离方程式;
(2)①先判断氧化剂、氧化剂,然后根据氧化剂与还原剂的物质的量之比为4:1来判断氧化产物;
②根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐;
(3)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,书写化学方程式.
解答 解:(1)H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为:H3PO2?H2PO2-+H+,
故答案为:H3PO2?H2PO2-+H+;
(2)①该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,反应中Ag+为氧化剂,H3PO2为还原剂,P的化合价升高了4价,银的化合价也应该降低4价,所以Ag元素的前边都是系数4,反应的方程式为H3PO2+4AgNO3+2H2O=4Ag↓+4HNO3+H3PO4,所以氧化产物为H3PO4,故答案为:H3PO4;
②由于H3PO2是一元中强酸,所以NaH2PO2为正盐,是强碱弱酸盐,水解呈碱性,
故答案为:正盐,弱碱性;
(3)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,反应方程式为2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑.
点评 本题考查了盐的水解原理、弱电解质的电离、氧化还原反应等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
4.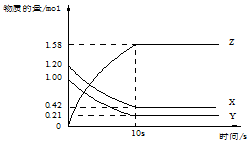 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.158mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应的化学方程式为:X(g)+Y(g)?Z(g) | |
| D. | 反应开始到10s时,Y的转化率为79.0% |
5.下列分子的立体构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH3═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4 ⑦HCHO.
①BF3 ②CH3═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4 ⑦HCHO.
| A. | ①②③⑦ | B. | ①⑤⑥ | C. | ②③④⑦ | D. | ③⑤⑥ |
2.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有 H+ | |
| D. | 新制的氯水能使红色布条褪色,说明氯水中含有Cl2 |
6.“APEC蓝”是形容2014年APEC会议期间北京蓝蓝的天,如何留住“APEC蓝”,倡导低碳社会也是一个重要的方面,研究CO2的利用对促进低碳社会的构建具有重要意义.二氧化碳合成甲醇是碳减排的新方向,
(1)已知:
①2H2(g)+O2(g)═2H2O(g)△H=-484.0kJ/mol
②CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
请写出甲醇的燃烧热的热化学方程式,CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-765kJ/mol该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})}{c(C{H}_{3}OH){c}^{\frac{3}{2}}({O}_{2})}$.
(2)向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是ad.
a、混合气体的平均式量保持不变 b、CO2和H2的转化率相等
c、CO2和H2的体积分数保持不变 d、混合气体的密度保持不变
e、1mol CO2生成的同时有1mol C-H键断裂
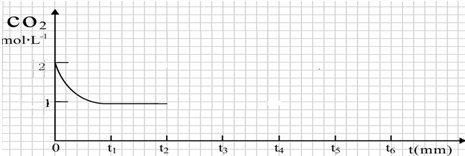
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.
(3)改变条件,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.反应过程中部分数据如表:
①达到平衡时,该反应逆反应平衡常数K=6.75平衡时H2的 转化率是50%
②在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
(4)用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极的反应式为CO2+8e-+8H+=CH4+2H2O.
(1)已知:
①2H2(g)+O2(g)═2H2O(g)△H=-484.0kJ/mol
②CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
请写出甲醇的燃烧热的热化学方程式,CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-765kJ/mol该反应的平衡常数表达式为K=$\frac{c(C{O}_{2})}{c(C{H}_{3}OH){c}^{\frac{3}{2}}({O}_{2})}$.
(2)向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是ad.
a、混合气体的平均式量保持不变 b、CO2和H2的转化率相等
c、CO2和H2的体积分数保持不变 d、混合气体的密度保持不变
e、1mol CO2生成的同时有1mol C-H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.

(3)改变条件,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.反应过程中部分数据如表:
| 反应条件 | 反应时间 | CO2 (mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
| 恒温恒容 (T1℃、2L) | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 |
②在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
(4)用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极的反应式为CO2+8e-+8H+=CH4+2H2O.
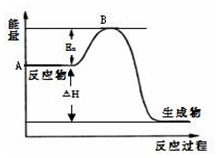 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答: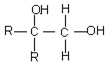 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$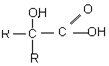

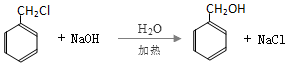 ;
;