题目内容
15.在一容积为2L的密闭容器中,加入1molA和3molB,保持温度为20℃,在催化剂存在的条件下,进行下列反应:A(g)+2B(g)?3C(g),达到平衡时生成1.5molC,平衡混合气中C的体积分数为ω;若将温度升高到50℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2mol.问:(1)20℃时,平衡混合气中C的体积分数ω=37.5%,该反应的平衡常数K=1.69(保留三位有效数字),
(2)该反应的平衡常数K随温度升高而减小(填“增大”、“减少”或“不变”),该反应的焓变△H<0(填“>”、“<”或“=”),
(3)20℃时,若在同一容器中加入2molA和6molB,达平衡后,C的物质的量为3mol,此时平衡混合气中C的体积分数不变(填“增大”、“减少”或“不变”),
(4)20℃时,若在同一容器中加入1molA、5molB和6molC,则平衡混合气中C的体积分数仍为ω,平衡时体系中A的物质的量浓度为0.75mol•L-1.
分析 (1)反应气体气体分子数目不变,则混合气体总物质的量不变,C的体积分数=$\frac{c的物质的量}{混合气体总物质的量}$×100%;
计算平衡时各组分物质的量,由于反应前后气体分子数目不变,利用物质的量代替浓度代入K=$\frac{{c}^{3}(C)}{c(A)×{c}^{2}(B)}$计算;
(2)升高温度,平衡时C的物质的量减小,说明平衡逆向移动,正反应为放热反应;
(3)等效为在原平衡基础上压强增大一倍,反应前后气体分子数目不变,不影响平衡移动,平衡时相同物质的含量相等;
(4)温度不变,改变起始投料量,平衡混合气中C的体积分数仍为ω,说明为等效平衡,反应前后气体分子数目不变,按化学计量数之比完全转化到方程式左边满足n(A):n(B)=1:3;
平衡时相同组分的原原平衡含量相同,则浓度之比等于混合气体总物质的量之比.
解答 解:(1)反应气体气体分子数目不变,则混合气体总物质的量不变,C的体积分数=$\frac{1.5mol}{1mol+3mol}$×100%=37.5%,
A(g)+2B(g)?3C(g)
起始量(mol):1 3 0
变化量(mol):0.5 1 1.5
平衡量(mol):0.5 2 1.5
由于反应前后气体分子数目不变,可以利用物质的量代替浓度计算平衡常数,故K=$\frac{{c}^{3}(C)}{c(A)×{c}^{2}(B)}$=$\frac{1.{5}^{3}}{0.5×{2}^{2}}$=1.69,
故答案为:37.5%;1.69;
(2)升高温度,平衡时C的物质的量减小,说明平衡逆向移动,平衡常数减小,正反应为放热反应,则△H<0,
故答案为:减小;<;
(3)等效为在原平衡基础上压强增大一倍,反应前后气体分子数目不变,不影响平衡移动,平衡时相同物质的含量相等,则达平衡后,C的物质的量为(2+6)mol×37.5%=3mol,
故答案为:3;不变;
(4)温度不变,改变起始投料量,平衡混合气中C的体积分数仍为ω,说明为等效平衡,反应前后气体分子数目不变,按化学计量数之比完全转化到方程式左边满足n(A):n(B)=1:3,设加入C为xmol,则:
(1+$\frac{1}{3}$x):(5+$\frac{2}{3}$x)=1:3
解得x=6,
平衡时相同组分的原原平衡含量相同,则平衡时A的浓度为$\frac{0.5mol}{2L}$×$\frac{(1+5+6)mol}{(1+3)mol}$=0.75mol/L,
故答案为:6;0.75.
点评 本题考查化学平衡计算、平衡常数计算与影响因素,关键是对等效平衡规律的理解掌握,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 硫酸 | B. | NaOH固体 | C. | NaCN固体 | D. | 水 |
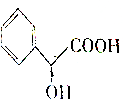 下列说法正确的是( )
下列说法正确的是( )| A. | 扁桃酸分子至多有10个原子在同一平面 | |
| B. | 扁桃酸在一定条件下能发生消去反应 | |
| C. | 某酯与扁桃酸互为同分异构体,苯环上有2个取代基且能与氯化铁发生显色反应,该酯的结构有3种 | |
| D. | 由苯乙烯(C6H5CH=CH2)合成扁桃酸需经过加成→水解→氧化→还原等步骤 |
 下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )| 实验目的 | 试剂 | 试管中的物质 | |
| A | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯②苯酚溶液 |
| B | 甲基对苯环的活性有影响 | 酸性KMnO4溶液 | ①苯②甲苯 |
| C | 苯分子中没有碳碳双键 | Br2的CCl2溶液 | ①苯②乙烯 |
| D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液②碳酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
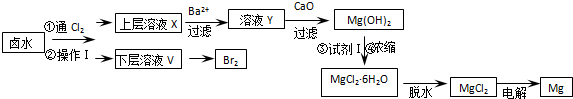
(1)操作Ⅰ的名称是萃取分液,所用主要玻璃仪器的名称是分液漏斗、烧杯.
(2)加入Ba2+的目的是除去溶液中的SO42-.用CaO调节溶液Y的pH,可以使Mg2+沉淀完全.由下表中数据可知,理论上选择pH范围是11.0<PH<12.2.
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
(4)化肥厂生产铵态氮肥(NH4)2SO4的部分流程如图:
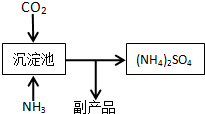
向装有CaSO4悬浊液的沉淀池中先通氨气,再通CO2的原因(请从溶解度和平衡移动角度分析)NH3极易溶于水且溶于水后电离出氢氧根离子,溶液显碱性,增加了二氧化碳的溶解性,生成了更多的CO32-,CO32-离子交换Ca2+形成更难溶的CaCO3,使CaSO4(s)?Ca2+(aq)+SO42-(aq)溶解平衡向右移动,提高(NH4)2SO4的产量.
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
| A. | 最高价氧化物对应的水化物碱性强弱:COH<D(OH)2 | |
| B. | 元素D、E可形成化合物,两元素的单质可通过电解该化合物的水溶液得到 | |
| C. | 化合物BA4和BAE3的空间结构均为正四面体 | |
| D. | 从化合价角度分析,有人认为元素A在周期表中的位置可以放在IA族、IVA族、VIIA族 |