题目内容
9.弱酸HCN溶液中存在着下列平衡:HCN?H++CN-,若要使平衡逆向移动,同时使c(H+)增大,应加入适量的下列物质是( )| A. | 硫酸 | B. | NaOH固体 | C. | NaCN固体 | D. | 水 |
分析 使平衡向逆反应方向移动,同时使c(H+)增大,则可加入含酸的物质,结合浓度对化学平衡的影响来解答.
解答 解:A.加硫酸,c(H+)增大,平衡逆向移动,故A正确;
B.加NaOH,消耗氢离子,平衡正向移动,同时使c(H+)减小,故B错误;
C.NaCN固体,c(CN-)增大,平衡向逆反应方向移动,同时使c(H+)减小,故C错误;
D.加水,电离平衡正向移动,同时使c(H+)减小,故D错误;
故选:A.
点评 本题考查电离平衡的影响因素,注意把握浓度对电离平衡的影响为解答的关键,明确逆向移动及c(H+)增大均满足即可解答,题目难度不大.

练习册系列答案
相关题目
19.Na和Na+两种粒子中,不相同的是( )
①核内质子数
②最内层电子数
③最外层电子数
④核外电子层数.
①核内质子数
②最内层电子数
③最外层电子数
④核外电子层数.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③④ |
20.将电解质分为强、弱电解质的依据是( )
| A. | 在一定条件下的电离程度 | B. | 属于离子化合物还是共价化合物 | ||
| C. | 熔融状态下是否完全电离 | D. | 溶于水后的导电能力是强还是弱 |
4.下列实验现象不能说明相关结论的是( )
| A. | 将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低 | |
| B. | 将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸具有酸性 | |
| C. | 向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl的溶解平衡正向移动 | |
| D. | 向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物 |
14.下列离子方程式书写正确的是( )
| A. | 在氯化铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3 | |
| B. | 在澄清石灰水中通入过量CO2:OH-+CO2=HCO3- | |
| C. | 在碳酸氢钙溶液中加入过量NaOH溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| D. | 碳酸钡中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O |
1.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后pH大于7,下表中判断合理的是( )
| 标号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 弱酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
18.下列化合物中,不能由单质直接化合得到的是( )
| A. | NO | B. | Na2O2 | C. | FeCl2 | D. | CuCl2 |
 .
.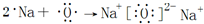 .
.