题目内容
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1mol Cl2与足量NaOH溶液反应,转移电子的数目为0.2NA |
| B、0.1mol苯乙烯中含有碳碳双键的数目为0.4NA |
| C、标准状况下,11.2L乙醇中含有羟基的数目为0.5NA |
| D、4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、氯气与氢氧化钠的反应为歧化反应;
B、苯环中无双键;
C、标况下,乙醇为液态;
D、NO2和N2O4的最简式均为NO2;
B、苯环中无双键;
C、标况下,乙醇为液态;
D、NO2和N2O4的最简式均为NO2;
解答:
解:A、氯气与氢氧化钠的反应为歧化反应氯气既做氧化剂又做还原剂,1mol氯气转移1mol电子,故0.1mol氯气转移0.1mol电子,故A错误;
B、苯环中无双键,故1mol苯乙烯中含1mol碳碳双键,故B错误;
C、标况下,乙醇为液态,故C错误;
D、NO2和N2O4的最简式均为NO2,故4.6gNO2和N2O4中含NO2的物质的量n=
=1mol,故含有的氧原子的物质的量为2mol,个数为2NA个,故D正确;
故选D.
B、苯环中无双键,故1mol苯乙烯中含1mol碳碳双键,故B错误;
C、标况下,乙醇为液态,故C错误;
D、NO2和N2O4的最简式均为NO2,故4.6gNO2和N2O4中含NO2的物质的量n=
| 46g |
| 46g/mol |
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
将容积为50mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL.则原混合气体中NO2和O2体积比可能是( )
| A、9:1 | B、18:7 |
| C、41:9 | D、1:1 |
下列条件下,两物质所含分子数不相等的是( )
| A、同温度、相同质量的N2和CO |
| B、常温常压,同体积的H2O和O2 |
| C、同压强、同物质的量的N2和O2 |
| D、同体积、同密度的N2和CO |
某学习小组用锌片、铜片和稀硫酸进行原电池的相关探究,下列说法正确的是( )
| A、溶液的pH增大 |
| B、溶液中的H+向锌电极定向移动 |
| C、锌电极的反应为2H++2e-=H2↑ |
| D、外电路中,电子由铜电极转移到锌电极 |
下列关于各图象的解释或结论正确的是( )
A、.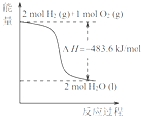 热化学方程式是H2(g)+
| ||
B、.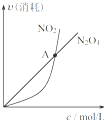 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | ||
C、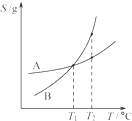 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | ||
D、.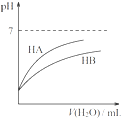 同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者 |
向体积为VL的NaALO2溶液中,开始通入amolHCl气体,则有bmol沉淀析出,继续通入cmolHCl气体后,产生的沉淀又恰好溶解,则原NaAlO2溶液的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
