题目内容
下列条件下,两物质所含分子数不相等的是( )
| A、同温度、相同质量的N2和CO |
| B、常温常压,同体积的H2O和O2 |
| C、同压强、同物质的量的N2和O2 |
| D、同体积、同密度的N2和CO |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.N2和CO的摩尔质量相等,质量相等时其物质的量相等,根据N=nNA计算其分子数;
B.常温常压下,水是液体,氧气是气体,相同体积的H2O和O2物质的量不等;
C.物质的量相等的N2和O2分子数相等;
D.同体积、同密度的N2和CO质量相等,二者摩尔质量相等,所以其物质的量相等.
B.常温常压下,水是液体,氧气是气体,相同体积的H2O和O2物质的量不等;
C.物质的量相等的N2和O2分子数相等;
D.同体积、同密度的N2和CO质量相等,二者摩尔质量相等,所以其物质的量相等.
解答:
解:A.N2和CO的摩尔质量相等,质量相等时其物质的量相等,根据N=nNA知,其分子数相等,故A不选;
B.常温常压下,水是液体,氧气是气体,相同体积的H2O和O2物质的量不等,则其分子数一定不等,故B选;
C.物质的量相等时,根据N=nNA知N2和O2分子数相等,故C不选;
D.同体积、同密度的N2和CO质量相等,二者摩尔质量相等,所以其物质的量相等,根据N=nNA知其分子数相等,故D不选;
故选B.
B.常温常压下,水是液体,氧气是气体,相同体积的H2O和O2物质的量不等,则其分子数一定不等,故B选;
C.物质的量相等时,根据N=nNA知N2和O2分子数相等,故C不选;
D.同体积、同密度的N2和CO质量相等,二者摩尔质量相等,所以其物质的量相等,根据N=nNA知其分子数相等,故D不选;
故选B.
点评:本题考查阿伏伽德罗定律及其推论,只要物质的量相等的气体其分子数一定相等,注意气体摩尔体积的适用范围及适用条件,易错选项是B.

练习册系列答案
相关题目
下列有关化学用语的表示正确的是( )
A、NH4Cl的电子式: | ||
B、S的结构示意图: | ||
C、中子数为21的钾原子:
| ||
D、对硝基苯酚的结构简式: |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1mol Cl2与足量NaOH溶液反应,转移电子的数目为0.2NA |
| B、0.1mol苯乙烯中含有碳碳双键的数目为0.4NA |
| C、标准状况下,11.2L乙醇中含有羟基的数目为0.5NA |
| D、4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是( )
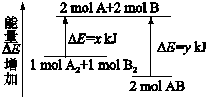

| A、该反应是吸热反应 |
| B、断裂2 mol A-B键需要吸收y kJ的能量 |
| C、2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
| D、断裂1 mol A-A键和1 mol B-B键能放出x kJ的能量 |