题目内容
二氧化铈(CeO2)是一种重要的稀土氧化物.平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质).某课题组以此粉末为原料回收铈,设计实验流程如下:

(1)写出步骤①反应的离子方程式: ;
(2)洗涤滤渣A的目的是为了除去 (填离子符号);
(3)第②步反应的离子方程式是: ,滤渣B的主要成分是 .
(4)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶.实验室进行萃取操作时用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等.
(5)取上述流程中得到的Ce(OH)4产品0.54g,加硫酸溶解后,用0.10mol?L-1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25mL标准溶液.该产品中Ce(OH)4的质量分数为: (保留2位有效数字).

(1)写出步骤①反应的离子方程式:
(2)洗涤滤渣A的目的是为了除去
(3)第②步反应的离子方程式是:
(4)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP
(5)取上述流程中得到的Ce(OH)4产品0.54g,加硫酸溶解后,用0.10mol?L-1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25mL标准溶液.该产品中Ce(OH)4的质量分数为:
考点:金属的回收与环境、资源保护,物质的分离、提纯和除杂
专题:实验题
分析:根据该反应过程为:①CeO2、SiO2、Fe2O3等中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;②加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;③加入碱后Ce3+转化为沉淀,④通入氧气讲Ce从+3氧化为+4,得到产品;
(1)写出步骤①反应为氧化铁溶于硫酸反应生成硫酸铁和水;
(2)根据滤渣A上含有FeCl3;
(3)根据氧化还原反应中电子得失守恒来分析;滤渣B为SiO2;
(4)根据萃取剂与水不互溶;
(5)根据电子守恒建立关系式:Ce(OH)4~FeSO4,然后进行计算求出Ce(OH)4的质量,最后求出质量分数.
(1)写出步骤①反应为氧化铁溶于硫酸反应生成硫酸铁和水;
(2)根据滤渣A上含有FeCl3;
(3)根据氧化还原反应中电子得失守恒来分析;滤渣B为SiO2;
(4)根据萃取剂与水不互溶;
(5)根据电子守恒建立关系式:Ce(OH)4~FeSO4,然后进行计算求出Ce(OH)4的质量,最后求出质量分数.
解答:
解:(1)写出步骤①反应为氧化铁溶于硫酸反应生成硫酸铁和水,步骤①反应的离子方程式:Fe2O3+6H+═2Fe3++3H2O;
故答案为:Fe2O3+6H+═2Fe3++3H2O;
(2)滤渣A上含有FeCl3,洗涤滤渣A的目的是为了除去Fe3+;故答案为:Fe3+;
(3)稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的离子方程式为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;加入稀硫酸和H2O2,CeO2转化为Ce3+,SiO2不反应,滤渣B的成分为SiO2,
故答案为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;SiO2;
(4)化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,所以TBP不能与水互溶,故答案为:不能;分液漏斗;
(5)Ce(OH)4 ~FeSO4
0.0025mol 0.1000mol/L-1×0.025L
所以m(Ce(OH)4)=0.0025mol×208g/mol=0.52g,产品中Ce(OH)4的质量分数为
×100%=96%,
故答案为:96%.
故答案为:Fe2O3+6H+═2Fe3++3H2O;
(2)滤渣A上含有FeCl3,洗涤滤渣A的目的是为了除去Fe3+;故答案为:Fe3+;
(3)稀硫酸、H2O2,CeO2三者反应生成转化为Ce2(SO4)3、O2和H2O,反应的离子方程式为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;加入稀硫酸和H2O2,CeO2转化为Ce3+,SiO2不反应,滤渣B的成分为SiO2,
故答案为:6H++H2O2+2CeO2=2Ce3++O2 ↑+4H2O;SiO2;
(4)化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,所以TBP不能与水互溶,故答案为:不能;分液漏斗;
(5)Ce(OH)4 ~FeSO4
0.0025mol 0.1000mol/L-1×0.025L
所以m(Ce(OH)4)=0.0025mol×208g/mol=0.52g,产品中Ce(OH)4的质量分数为
| 0.52g |
| 0.54g |
故答案为:96%.
点评:本题以工艺流程为基础,考查化学实验基本操作、元素及化合物知识、化学计算、氧化还原反应等相关知识,题目难度中等.

练习册系列答案
相关题目
如图两种化合物的结构或性质描述正确的是( )


| A、不是同分异构体 |
| B、均是芳香族化合物 |
| C、均能与溴水反应 |
| D、可用红外光谱区分,但不能用核磁共振氢谱区分 |
化合物C是制备液晶材料的中间体之一,它可由A和B在一定条件下制得下列说法正确的是( )
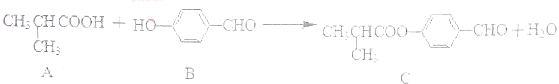
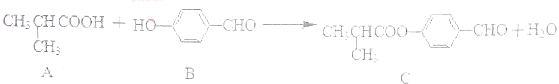
| A、每个A分子中含有1个手性碳原子 |
| B、可以用酸性KMnO4溶液检验B中是否含有醛基 |
| C、1molC分子最多可与4molH2发生加成反应 |
| D、C可发生加成反应、取代反应、氧化反应、消去反应 |
下列物质中,既能和酸反应又能和碱反应的化合物是( )
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3.
| A、②③④ | B、①②④ |
| C、①②③④ | D、①③④ |
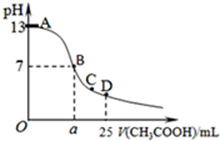 某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是
某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是( )
| A、在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| B、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C、在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| D、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
已知某温度下,Ksp(AgCl)=1.56×10-10 mol2?L-2,Ksp(Ag2CrO4)=1.12×10-12 mol3?L-3,下列叙述正确的是( )
| A、向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| B、向2.0×10-4mol?L-1的K2CrO4溶液中加入等体积的2.0×10-4 mol?L-1 AgNO3溶液,则有Ag2CrO4沉淀生成 |
| C、将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中Cl-的物质的量浓度最大 |
| D、将0.001 mol?L-1的AgNO3溶液逐滴滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4的混合溶液中,则先产生AgCl沉淀 |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、0.1mol Cl2与足量NaOH溶液反应,转移电子的数目为0.2NA |
| B、0.1mol苯乙烯中含有碳碳双键的数目为0.4NA |
| C、标准状况下,11.2L乙醇中含有羟基的数目为0.5NA |
| D、4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
 请回答下列问题
请回答下列问题