题目内容
19.已知:4P(红磷,S)═P4(白磷,s)△H=+17kJ•moL-1,则下列推论正确的是( )| A. | 当1 mol白磷完全转变成红磷时放出17kJ热量 | |
| B. | 正反应是一个放热反应 | |
| C. | 当4g红磷转变成白磷时吸收I7k J热量 | |
| D. | 白磷比红磷稳定 |
分析 由△H=+17kJ•moL-1可知,正反应为吸热反应,则逆反应为放热反应,能量低的物质稳定,结合物质的量与反应中能量变化成正比计算.
解答 解:A.4P(红磷,s)═P4(白磷,s)△H=+17kJ•moL-1,则P4(白磷,s)═4P(红磷,s)△H=-17kJ•moL-1,即当1 mol白磷完全转变成红磷时放出17kJ热量,故A正确;
B.由△H=+17kJ•moL-1可知,正反应为吸热反应,故B错误;
C.由反应可知,4mol红磷转变成白磷时吸收I7k J热量,故C错误;
D.由反应可知,红磷的能量低,则红磷稳定,故D错误;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、物质的量与能量的关系为解答的关键,侧重分析与应用能力的考查,注意能量低的物质稳定,题目难度不大.

练习册系列答案
相关题目
8.五种元素X、Y、Z、W、M在周期表中位置关系如表,其中X、Y、Z、W是短周期元素,Z的气态氢化物与其低价氧化物能反应生成该元素单质的元素.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| M |
| A. | X、Y、Z、W形成的单质中都含有非极性共价键 | |
| B. | 元素最高价氧化物水化物对应的酸性大小W>Z,简单离子半径大小 关系:W>Z>X | |
| C. | M的氢化物的沸点高于X的,化合物M2O3有氧化性和还原性 | |
| D. | 有“海洋元素”美誉的元素与M同周期与W同主族 |
9.在NH4CuSO3中加入足量稀硫酸并微热,生成红色固体X、刺激性气味气体Y及蓝色溶液Z,下列说法正确的是( )
| A. | 在该反应中,硫元素被氧化 | |
| B. | 上述反应中,Y为氮气 | |
| C. | 红色固体是氧化亚铜 | |
| D. | 98g H2SO4参与反应,必转移0.5NA个电子(NA为阿伏伽德罗常数的值) |
14.低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)$\stackrel{催化剂}{?}$2N2(g)+3H2O(g)△H<0.在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,增加NH3的浓度,反应速率会降低 | |
| B. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 | |
| C. | 其他条件不变,充入氦气,压强增大,化学反应速率增大 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
4.COCl2(g)?CO(g)+Cl2(g)△H>0,当反应达到平衡时,下列措施能提高COCl2转化率的是( )
| A. | 恒容通入惰性气体 | B. | 恒压时通入惰性气体 | ||
| C. | 恒容通入COCl2气体 | D. | 加催化剂 |
11.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 漂白粉的成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥HI气体 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | Cl2与SO2以等物质的量比同时通入品红溶液,能增强其漂白性 |
9.某物质的结构为: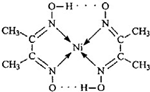 .对该物质的分析判断正确的是( )
.对该物质的分析判断正确的是( )
 .对该物质的分析判断正确的是( )
.对该物质的分析判断正确的是( )| A. | 该物质是中不存在σ键 | |
| B. | 该物质的分子中只含有共价键、配位键两种作用力 | |
| C. | 该物质是一种配合物,其中N 原子为配位体 | |
| D. | 该物质中C、N、O 原子存在孤对电子 |
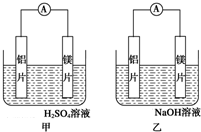 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.