题目内容
9.在NH4CuSO3中加入足量稀硫酸并微热,生成红色固体X、刺激性气味气体Y及蓝色溶液Z,下列说法正确的是( )| A. | 在该反应中,硫元素被氧化 | |
| B. | 上述反应中,Y为氮气 | |
| C. | 红色固体是氧化亚铜 | |
| D. | 98g H2SO4参与反应,必转移0.5NA个电子(NA为阿伏伽德罗常数的值) |
分析 由信息可知,酸性条件下,有红色固体生成,则生成Cu,产生刺激性气味的气体,则生成SO2,溶液呈现蓝色,则生成Cu2+,即NH4CuSO3与足量的硫酸溶液混合微热生成硫酸铜、硫酸铵、二氧化硫、Cu,其反应为反应的方程式为2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,显然该反应中只有Cu元素的化合价升降,以此来解答.
解答 解:由信息可知,酸性条件下,有红色固体生成,则生成Cu,产生刺激性气味的气体,则生成SO2,溶液呈现蓝色,则生成Cu2+,即NH4CuSO3与足量的硫酸溶液混合微热生成硫酸铜、硫酸铵、二氧化硫、Cu,其反应为反应的方程式为2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,显然该反应中只有Cu元素的化合价升降,
A.NH4CuSO3中硫元素的化合价不变,故A错误;
B.酸性条件下,产生刺激性气味的气体,则生成SO2,即Y为SO2,故B错误;
C.由分析可知,红色固体为Cu,故C错误;
D.2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,由方程式可知,反应只有Cu元素的化合价发生变化,分别由+1→+2,+1→0,每2molH2SO4参加反应则转移1mol电子,则1molH2SO4完全反应转移0.5mol电子,故D正确;
故选D.
点评 本题考查氧化还原反应,明确现象与生成物的关系,并准确判断元素的化合价变化是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
19.下列各组物质反应后,再滴入KSCN溶液,显红色的是( )
| A. | 向CuCl2溶液中加入铁粉 | |
| B. | 向FeO粉末中加入稀硫酸 | |
| C. | 单质Fe与过量稀盐酸反应后的溶液中再加入少量氯水 | |
| D. | Fe(OH)3与过量稀盐酸反应后的溶液中再加入过量铁粉 |
20.下列离子方程式,正确的是( )
| A. | 氯化铝溶液与过量氨水 Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 明矾净水原理:Al3++3H2O→Al(OH)3↓+3H+ | |
| C. | 将足量氯气通入溴化亚铁溶液:2Fe2++Cl2→2Fe3++2Cl- | |
| D. | 偏铝酸钠溶液与过量盐酸AlO2-+H++H2O→Al(OH)3↓ |
17.如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验.试回答下列问题:
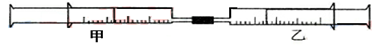
(1)实验1中,沉淀最终变为红褐色,写出沉淀变色的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)实验2甲针筒内的现象是:溶液变血红.
(3)实验3中,甲针筒内开始时的现象是:白色沉淀;若甲针筒内产生的沉淀的质量为0.39g,则则需向甲针筒内注入该NaOH溶液15 mL或35mL.
(4)实验4中,若持续向甲针筒内注入1mol/LBa(OH)2溶液,当生成沉淀的物质的量最大时,沉淀成分为BaSO4和Al(OH)3.(填化学式,下同).当生成沉淀的质量最大时,沉淀成分为BaSO4.

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 10mL FeSO4溶液 | 10mLNH3 | 生成白色沉淀,后变色 |
| 2 | 5mL1mol/L FeCl3溶液 | 1mL1mol/L KSCN溶液 | |
| 3 | 10mL1mol/LAlCl3溶液 | 1mol/L NaOH | |
| 4 | 10mL2mol/LKAl(SO4)2溶液 | 1mol/LBa(OH)2溶液 |
(2)实验2甲针筒内的现象是:溶液变血红.
(3)实验3中,甲针筒内开始时的现象是:白色沉淀;若甲针筒内产生的沉淀的质量为0.39g,则则需向甲针筒内注入该NaOH溶液15 mL或35mL.
(4)实验4中,若持续向甲针筒内注入1mol/LBa(OH)2溶液,当生成沉淀的物质的量最大时,沉淀成分为BaSO4和Al(OH)3.(填化学式,下同).当生成沉淀的质量最大时,沉淀成分为BaSO4.
4.国际元素相对原子量表上查得N是14.01,这是指氮的( )
| A. | 平均相对原子质量 | B. | 相对原子质量 | ||
| C. | 质量数 | D. | 同位素相对原子质量 |
14.Cu2O和CuO组成的混合物中,Cu的质量分数为88%,则混合物中含Cu2O和CuO的物质的量之比( )
| A. | 5:1 | B. | 4:1 | C. | 3:2 | D. | 1:5 |
2.已知lg3=0.48,25℃时NH3•H2O的电离平衡常数为1.8×10-5,现向0.2mol/L的氨水中滴加等体积的0.1mol/L的盐酸得到新溶液Q,下列有关说法中错误的是( )
| A. | 此氨水的pH为11.48 | |
| B. | Q溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | Q溶液中:2c(Cl-)=c(NH3•H2O)+c(NH4+) | |
| D. | 滴加过程中,溶液中可能会存在:c(NH4+)=c(Cl-) |
19.已知:4P(红磷,S)═P4(白磷,s)△H=+17kJ•moL-1,则下列推论正确的是( )
| A. | 当1 mol白磷完全转变成红磷时放出17kJ热量 | |
| B. | 正反应是一个放热反应 | |
| C. | 当4g红磷转变成白磷时吸收I7k J热量 | |
| D. | 白磷比红磷稳定 |
 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O;
+H2O;