题目内容
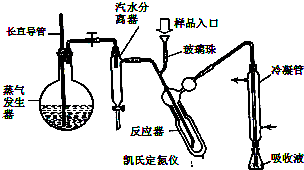 蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.
蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.已知:2NH3+4H3BO3→(NH4)2B4O7+5H2O
(NH4)2B4O7+2HCl+5H2O→2NH4Cl+4H3BO3
实验步骤
1.称取婴幼儿奶粉2.000g,移入干燥的消化管中,加入0.2g硫酸铜、3g硫酸钾及20mL硫酸,充分加热冷却后移入100mL容量瓶中,用水定容至100mL(消化液).
2.碱化蒸馏
在锥形瓶中加入10mL2%硼酸、2滴混合指示剂,并吸取10.0mL样品消化液从样品入口注入凯氏定氮仪.用10mL蒸馏水冲洗样品入口,再加10mL50%氢氧化钠溶液,打开水蒸汽发生器与反应器之间的夹子,蒸汽通入反应器使氨气全部被蒸发出来,并通过冷凝管而进入锥形瓶内.加热蒸气发生器5min,取下锥形瓶.
3.滴定
用酸式滴定管,以0.0500mol/L盐酸标准溶液进行滴定至终点.重复上述实验三次,所用盐酸平均体积为5.00mL.试回答下列问题
(1)加入K2SO4是为了升高溶液的沸点,加入CuSO4作用可能是:
(2)蒸气发生器中长直导管的作用是:
(3)如何确定氨全部被水蒸出并进入锥形瓶:
(4)本次测定中,该奶粉中蛋白质的质量分数为:
(5)奶粉含下列杂质或实验操作中,会使计算结果中蛋白质含量值“增加”的是
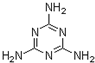
A.含三聚氰胺(
 ) B.样品入口未用蒸馏水冲洗
) B.样品入口未用蒸馏水冲洗C.定容消化液时俯视刻度线 D.滴定开始时仰视读数,滴定终点时俯视读数.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据催化剂原理分析;
(2)根据反应装置压力过大可能会发生危险及冷却时可能发生倒吸现象进行判断长导管的作用;
(3)根据氨气的性质解答;
(4)根据N元素守恒,及滴定反应找出N原子与HCl的关系式,根据关系式计算;
(5)根据氮的含量进行误差分析.
(2)根据反应装置压力过大可能会发生危险及冷却时可能发生倒吸现象进行判断长导管的作用;
(3)根据氨气的性质解答;
(4)根据N元素守恒,及滴定反应找出N原子与HCl的关系式,根据关系式计算;
(5)根据氮的含量进行误差分析.
解答:
解:(1)加入CuSO4后,CuSO4不参与反应,可能起催化作用,
故答案为:催化剂;
(2)加热产生水蒸气,装置内压强增加,长导管防止装置中压力过大而发生危险,冷却时防止发生倒吸,起安全管作用;故答案为:安全管;
(3)取最后一滴冷凝流出液,用红色石蕊试纸(或pH试纸)检验不变蓝(显中性),则证明氨全部被水蒸出并进入锥形瓶,
故答案为:取最后一滴冷凝流出液,用红色石蕊试纸(或pH试纸)检验不变蓝(显中性);
(4)根据关系式:
2N~(NH4)2B4O7~2HCl
28g 2mol
mg 0.0050L×0.0500mol/L
则m×2mol=28g×0.0050L×0.0500mol/L,
解得:m=0.0035g,
该奶粉中蛋白质的质量分数为
×
×6.25×100%=10.94%;
故答案为:10.94%;
(5)A.三聚氰胺( )含氮量高,会使计算结果中蛋白质含量值“增加”;
)含氮量高,会使计算结果中蛋白质含量值“增加”;
B.样品入口未用蒸馏水冲洗,损失了氮元素,会使计算结果中蛋白质含量值偏低;
C.定容消化液时俯视刻度线,读数偏小,根据c=
,会使计算结果中蛋白质含量值“增加”;
D.滴定开始时仰视读数,滴定终点时俯视读数,盐酸读数偏小,会使计算结果中蛋白质含量值偏低;
故答案为:AC.
故答案为:催化剂;
(2)加热产生水蒸气,装置内压强增加,长导管防止装置中压力过大而发生危险,冷却时防止发生倒吸,起安全管作用;故答案为:安全管;
(3)取最后一滴冷凝流出液,用红色石蕊试纸(或pH试纸)检验不变蓝(显中性),则证明氨全部被水蒸出并进入锥形瓶,
故答案为:取最后一滴冷凝流出液,用红色石蕊试纸(或pH试纸)检验不变蓝(显中性);
(4)根据关系式:
2N~(NH4)2B4O7~2HCl
28g 2mol
mg 0.0050L×0.0500mol/L
则m×2mol=28g×0.0050L×0.0500mol/L,
解得:m=0.0035g,
该奶粉中蛋白质的质量分数为
| 0.0035g |
| 2.000g |
| 100mL |
| 10mL |
故答案为:10.94%;
(5)A.三聚氰胺(
 )含氮量高,会使计算结果中蛋白质含量值“增加”;
)含氮量高,会使计算结果中蛋白质含量值“增加”;B.样品入口未用蒸馏水冲洗,损失了氮元素,会使计算结果中蛋白质含量值偏低;
C.定容消化液时俯视刻度线,读数偏小,根据c=
| n |
| V |
D.滴定开始时仰视读数,滴定终点时俯视读数,盐酸读数偏小,会使计算结果中蛋白质含量值偏低;
故答案为:AC.
点评:本题考查了蛋白质中含氮量测定方法,题目难度较大,试题涉及了元素化合物、实验原理、化学计算等,侧重考查学生对实验方案理解、元素化合物的知识,难度较大,易错点为计算液态奶的含氮量时盐酸体积是平均值.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)?CO2(g)+H2(g),部分数据见表(表中t2>t1):下列说法错误的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
A、反应在t1 min末的速率为v(H2)=
| ||
| B、平衡时水蒸气的转化率为66.67% | ||
| C、该温度下反应的平衡常数为1 | ||
| D、其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时水蒸气的转化率为33.33% |
根据下列实验方法和现象,得出结论正确的是( )
A、某溶液
| ||
B、某溶液
| ||
C、某溶液
| ||
D、某溶液
|
总质量一定时,不论以任何比例混合,完全燃烧生成CO2与H2O的量为定值的是( )
| A、C3H8O和C2H6O |
| B、C2H4和C3H8 |
C、 和C2H4 和C2H4 |
| D、CH2O和C2H4O2 |


 →RCHO+H2O
→RCHO+H2O ,经过的反应是
,经过的反应是
