题目内容
工业上用电解法制备铝单质,写出反应方程式 ;当产生标准状况下氧气22.4L时,反应转移了 mol电子;消耗 mol氧化铝.
考点:化学方程式的书写,化学方程式的有关计算
专题:
分析:工业上电解熔融氧化铝获得金属铝,反应的化学方程式为:2Al2O3(熔融)
4Al+3O2↑;根据n=
计算出氧气的物质的量,再根据化合价变化计算出转移电子的物质的量;根据要求的物质的量计算出消耗氧化铝的物质的量.
| ||
| V |
| Vm |
解答:
解:电解熔融氧化铝可以获得金属铝和氧气,反应方程式为:2Al2O3(熔融)
4Al+3O2↑;
标准状况下22.4L氧气的物质的量为:
=1mol,
氧化铝中氧元素的化合价为-2价,生成1mol氧气转移的电子为:(2-0)×2×1mol=4mol,
根据反应可知,生成1mol氧气消耗氧化铝的物质的量为:n(Al2O3)=1mol×
=
mol,
故答案为:2Al2O3(熔融)
4Al+3O2↑;4;
.
| ||
标准状况下22.4L氧气的物质的量为:
| 22.4L |
| 22.4L/mol |
氧化铝中氧元素的化合价为-2价,生成1mol氧气转移的电子为:(2-0)×2×1mol=4mol,
根据反应可知,生成1mol氧气消耗氧化铝的物质的量为:n(Al2O3)=1mol×
| 2 |
| 3 |
| 2 |
| 3 |
故答案为:2Al2O3(熔融)
| ||
| 2 |
| 3 |
点评:本题考查了化学方程式的书写及计算,题目难度中等,注意掌握常见反应方程式的书写方法,明确氧化还原反应中电子转移数目的计算方法,试题有利于培养学生的分析能力及化学计算能力.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、HCO3-的水解:HCO3-+H2O?CO32-+H3O+ |
| B、Na2S的水解:S2-+2H2O?H2S+2OH- |
| C、Fe3+的检验:Fe3++3SCN-?Fe(SCN)3↓ |
| D、Cu(OH)2溶于氨水形成深蓝色溶液:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O |
1977年在印度洋东南部马德里斯的一个海湾里,一阵飓风过后,海面的巨浪上竟燃烧着熊熊大火.海水会燃烧的原因是( )
| A、时速达280公里的飓风与海水发生剧烈摩擦,产生的巨大热能使水分子分解,引起氢气燃烧 |
| B、飓风使海水分子运动速度加快,产生的热能使海水中植物燃烧 |
| C、海面上漂浮的油层被氧化而燃烧 |
| D、以上叙述都正确 |
向淀粉中加入少量的稀硫酸,加热使之发生水解,为测定水解的程度所需下列试剂是( )
①NaOH溶液 ②新制Cu(OH)2溶液 ③碘水 ④BaCl2溶液.
①NaOH溶液 ②新制Cu(OH)2溶液 ③碘水 ④BaCl2溶液.
| A、②③ | B、①②③ |
| C、①②④ | D、②③④ |






 是E的最简单的同系物,试以丙酮酸为原料合成乙二酸(用合成路线流程图表示,并注明反应条件)
是E的最简单的同系物,试以丙酮酸为原料合成乙二酸(用合成路线流程图表示,并注明反应条件)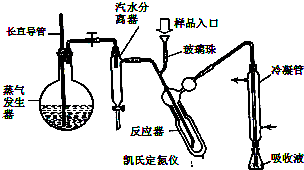 蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.
蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.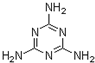 ) B.样品入口未用蒸馏水冲洗
) B.样品入口未用蒸馏水冲洗