题目内容
高锰酸钾是中学常用的试剂.工业上用软锰矿制备高锰酸钾流程如下.

(1)铋酸钠(不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式 .
(2)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是 (填代号).
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有 、 (写化学式).
(4)理论上(若不考虑物质循环与制备过程中的损失)1mol MnO2可制得 mol KMnO4.
(5)该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式 ,所需气体产生装置是 (选填代号).

(6)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体.

(1)铋酸钠(不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式
(2)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有
(4)理论上(若不考虑物质循环与制备过程中的损失)1mol MnO2可制得
(5)该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式

(6)操作Ⅰ的名称是
考点:制备实验方案的设计
专题:实验设计题
分析:二氧化锰与氢氧化钾在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,滤液中含有K2CO3,在滤液中加氢氧化钙得到碳酸钙沉淀和KOH;
(1)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+;
(2)KMnO4有强氧化性,消毒原理与84消毒液、双氧水一样;
(3)根据流程分析,最初反应物中和最终生成物中含有的物质就能循环利用;
(4)最初的原料中1mol MnO2恰好得到1mol K2MnO4,根据3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2计算;
(5)实验室用盐酸与石灰石制备二氧化碳,反应不需要加热,可以用启普发生器制备;
(6)分离固体与溶液,采用过滤操作,利用KMnO4和K2CO3在溶解性上进行分离.
(1)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+;
(2)KMnO4有强氧化性,消毒原理与84消毒液、双氧水一样;
(3)根据流程分析,最初反应物中和最终生成物中含有的物质就能循环利用;
(4)最初的原料中1mol MnO2恰好得到1mol K2MnO4,根据3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2计算;
(5)实验室用盐酸与石灰石制备二氧化碳,反应不需要加热,可以用启普发生器制备;
(6)分离固体与溶液,采用过滤操作,利用KMnO4和K2CO3在溶解性上进行分离.
解答:
解:二氧化锰与氢氧化钾在空气中熔融,加水溶解得到K2MnO4溶液,通入二氧化碳得到KMnO4、MnO2、K2CO3,过滤除去滤渣(MnO2),滤液为KMnO4、K2CO3溶液,浓缩结晶,趁热过滤得到KMnO4晶体,滤液中含有K2CO3,在滤液中加氢氧化钙得到碳酸钙沉淀和KOH;
(1)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+,则反应的离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
故答案为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
(2)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故答案为:ab;
(3)根据流程分析可知:在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用;
故答案为:MnO2;KOH;
(4)由2MnO2+4KOH+O2
2K2MnO4+2H2O 可知最初的原料中1mol MnO2恰好得到1mol K2MnO4.由3K2MnO4+2CO2=2KMnO4+2K2CO3+MnO2知,1mol K2MnO4在反应中能得到
molKMnO4,
故答案为:
;
(5)实验室用盐酸与石灰石制备二氧化碳,其反应的方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,反应不需要加热,可以用启普发生器制备,所以选用的装置为A或C;
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;AC;
(6)该操作是分离固体与溶液,是过滤操作,KMnO4和K2CO3在溶解性上不同采用热的情况下采用浓缩结晶的方式可分离,
故答案为:过滤;溶解性;浓缩结晶.
(1)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+,则反应的离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
故答案为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
(2)KMnO4有强氧化性,利用其强氧化性杀菌消毒,消毒原理与84消毒液、双氧水一样,故答案为:ab;
(3)根据流程分析可知:在开始的反应物和最终的生成物中都含有MnO2和KOH,所以二氧化锰和氢氧化钾能循环使用;
故答案为:MnO2;KOH;
(4)由2MnO2+4KOH+O2
| ||
| 2 |
| 3 |
故答案为:
| 2 |
| 3 |
(5)实验室用盐酸与石灰石制备二氧化碳,其反应的方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,反应不需要加热,可以用启普发生器制备,所以选用的装置为A或C;
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;AC;
(6)该操作是分离固体与溶液,是过滤操作,KMnO4和K2CO3在溶解性上不同采用热的情况下采用浓缩结晶的方式可分离,
故答案为:过滤;溶解性;浓缩结晶.
点评:本题考查了物质的制备实验方案设计,涉及常见氧化剂与还原剂、氧化还原反应、化学计算和对工艺流程的理解、阅读题目获取信息的能力等,难度中等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

练习册系列答案
相关题目
下列有关实验原理或操作,正确的是( )
| A、镀层未破损的镀锌铁和镀层破损后的镀锌铁分别与盐酸反应时产生H2的速度相同 |
| B、用50mL酸式滴定管可准确量取25.00mL的Na2CO3溶液 |
| C、往新配制的淀粉溶液中滴加碘水,溶液显蓝色,加入足量NaOH后溶液褪色 |
| D、配制稀H2SO4溶液时,先在量筒中加入一定体积的水,再在不断搅拌下慢慢加浓H2SO4 |
含有C=C的有机物与O3作用形成不稳定的臭氧化物,臭氧化物在还原剂存在下,与水作用分解为羰基化合物,总反应为:
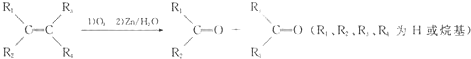
一以下四种物质发生上述反应,所得产物为纯净物且能发生银镜反应的是( )

一以下四种物质发生上述反应,所得产物为纯净物且能发生银镜反应的是( )
| A、(CH3)2═C(CH3)2 |
| B、2-氯-2-丁烯 |
C、 |
D、 |
常温下,0.1mol/LHA溶液的pH>1,0.1mol/LBaOH溶液中c(OH-):c(H+)=1012,将这两种溶液等体积混合,以下离子浓度关系判断正确的是( )
| A、c(H+)<c(OH-)<c(A-)<c(B+) |
| B、c(OH-)<c(H+)<c(B+)<c(A-) |
| C、c(A-)=c(B+)>c(H+)=c(OH-) |
| D、c(A-)=c(B+)<c(H+)=c(OH-) |


 某有机物A,由C、H、O三种元素组成,在一定条件下,有以下转变关系:(R-CH2CH2OH
某有机物A,由C、H、O三种元素组成,在一定条件下,有以下转变关系:(R-CH2CH2OH 蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.
蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量. ) B.样品入口未用蒸馏水冲洗
) B.样品入口未用蒸馏水冲洗