题目内容
一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)?CO2(g)+H2(g),部分数据见表(表中t2>t1):下列说法错误的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
A、反应在t1 min末的速率为v(H2)=
| ||
| B、平衡时水蒸气的转化率为66.67% | ||
| C、该温度下反应的平衡常数为1 | ||
| D、其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时水蒸气的转化率为33.33% |
考点:化学平衡的计算
专题:
分析:A、由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,根据v=
计算v(CO),再根据速率之比等于化学计量数之比计算v(H2);
B、t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol-0.4mol=0.2mol,t2min时水的物质的量为0.2mol,故t1min时反应到达平衡,根据转化率定义计算CO的转化率;
C、计算平衡时各组分的物质的量,该反应前后气体的物质的量不变,利用物质的量代替浓度代入平衡常数表达式计算;
D、CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O到达平衡时对应生成物的浓度、物质的量相同.
| ||
| △t |
B、t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol-0.4mol=0.2mol,t2min时水的物质的量为0.2mol,故t1min时反应到达平衡,根据转化率定义计算CO的转化率;
C、计算平衡时各组分的物质的量,该反应前后气体的物质的量不变,利用物质的量代替浓度代入平衡常数表达式计算;
D、CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O到达平衡时对应生成物的浓度、物质的量相同.
解答:
解:A、由表中数据可知,t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,v(CO)=
=
mol/(L?min),速率之比等于化学计量数之比计算v(H2)=v(CO)=
mol/(L?min),故A正确;
B、t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol-0.4mol=0.2mol,t2min时水的物质的量为0.2mol,故t1min时反应到达平衡,故CO的转化率为
×100%=33.3%,故B错误;
C、t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时n(CO)=0.8mol,n(H2O)=0.2mol,n(CO2)=c(H2)=△n(CO)=1.2mol-0.8mol=0.4mol,反应前后气体的体积不变,利用物质的量代替浓度计算7平衡常数,则k=
=1,故C正确
D、CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,消耗水物质的量为0.2mol,水蒸气的转化率=
×100%=33.33%,故D正确;
故选B.
| ||
| t1min |
| 0.2 |
| t1 |
| 0.2 |
| t1 |
B、t1min内参加反应的CO的物质的量为1.2mol-0.8mol=0.4mol,则参加反应的水为0.4mol,此时水的物质的量为0.6mol-0.4mol=0.2mol,t2min时水的物质的量为0.2mol,故t1min时反应到达平衡,故CO的转化率为
| 0.4mol |
| 1.2mol |
C、t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,此时n(CO)=0.8mol,n(H2O)=0.2mol,n(CO2)=c(H2)=△n(CO)=1.2mol-0.8mol=0.4mol,反应前后气体的体积不变,利用物质的量代替浓度计算7平衡常数,则k=
| 0.4×0.4 |
| 0.8×0.2 |
D、CO与H2O按物质的量比1:1反应,充入0.60 mol CO和1.20 mol H2O与充入1.20 mol CO和0.6mol H2O,平衡时生成物的浓度对应相同,t1min时n(CO)=0.8mol,n(H2O)=0.6mol-0.4mol=0.2mol,t2min时n(H2O)=0.2mol,说明t1min时反应已经达到平衡状态,消耗水物质的量为0.2mol,水蒸气的转化率=
| 0.2mol |
| 0.6mol |
故选B.
点评:本题是化学平衡问题,主要考查化学反应速率、化学平衡及平衡常数等计算,难度中等,注意D选项中的规律利用.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
下列物质中,能用来干燥H2的是( )
| A、NaHCO3 |
| B、Na2O2 |
| C、Na2CO3 |
| D、NaOH |
一定条件下,对于反应X(g)+3Y(g)?2Z(g).若起始时浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z浓度分别为0.1mol?L-1、0.3mol?L-1和0.08mol?L-1,则下列判断不合理的是( )
| A、c1:c2=1:3 |
| B、c1的取值范围为0<c1<0.14 |
| C、X和Y的转化率相等 |
| D、平衡时,Y和Z的生成速率之比2:3 |
 有机物A可发生如下变化,已知C为羧酸,且与D的相对分子质量相等,而E不能发生银镜反应,则A可能的结构有( )
有机物A可发生如下变化,已知C为羧酸,且与D的相对分子质量相等,而E不能发生银镜反应,则A可能的结构有( )| A、1种 | B、2种 | C、3种 | D、4种 |
下列溶液加热蒸干后,能析出溶质固体的是( )
| A、AlCl3 |
| B、K2SO3 |
| C、Fe2(SO4)3 |
| D、NH4HCO3 |

 在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)?pC(g)+qD(g).
在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)?pC(g)+qD(g).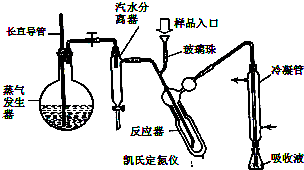 蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量.
蛋白质是有机态氮的表现形式之一,蛋白质样品(或其他含氮杂质)与硫酸和催化剂一同加热消化,使含氮物质分解,分解成的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,用硼酸吸收后再用盐酸标准溶液滴定,根据酸的消耗量求得氮的质量分数,乘以换算系数(奶粉中为6.25),即得蛋白质含量. ) B.样品入口未用蒸馏水冲洗
) B.样品入口未用蒸馏水冲洗 A是某工厂废旧机械表面上红色固体的主要成分Fe2O3,B、C、F都是单质,D、F都是无色无味的气体,它们之间的相互转化关系如图所示,请回答:
A是某工厂废旧机械表面上红色固体的主要成分Fe2O3,B、C、F都是单质,D、F都是无色无味的气体,它们之间的相互转化关系如图所示,请回答: