题目内容
15.C、N、O、Al、Si、Cu是常见的六种元素.(1)Si位于元索周期表第三周期第IVA族.
(2)N原子的原子结构示意图为
 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,t1时,原电池中电子流动方向发生改变,其原因是铝在浓硝酸中发生钝化,氧化膜阻止了Al进一步发生反应,Al作正极,当硝酸浓度降为一定浓度时变为稀硝酸,Al开始做负极,电子流动方向发生改变.
分析 (1)主族元素原子核外电子层数与其周期数相等,最外层电子数与其族序数相等;
(2)N原子核内有7个质子、核外有7个电子、两个电子层;氧化亚铜为砖红色;
(3)同一周期元素原子半径随着原子序数增大而减小;
同一周期元素电负性随着原子序数增大而增大;
原子晶体熔沸点与原子半径成反比;
不含氢键的分子晶体熔沸点与相对分子质量成正比;
(4)该原电池中,Cu作负极、Al作正极,正极上硝酸根离子得电子生成二氧化氮;电解质溶液中阳离子向正极移动、阴离子向负极移动,当浓硝酸浓度降低到一定程度是变为稀硝酸,Al易失电子而作负极.
解答 解:(1)Si原子核外有3个电子层、最外层电子数为4,所以位于第三周期第IVA族,
故答案为:三;ⅣA;
(2)N原子结构示意图为 ,氧化亚铜为砖红色,
,氧化亚铜为砖红色,
故答案为: ;砖红色;
;砖红色;
(3)同一周期元素原子半径随着原子序数增大而减小,所以原子半径Al>Si;
同一周期元素电负性随着原子序数增大而增大,所以电负性N<O;
原子晶体熔沸点与原子半径成反比,原子半径C<Si,所以熔沸点金刚石>晶体硅;
不含氢键的分子晶体熔沸点与相对分子质量成正比,相对分子质量甲烷<硅烷,所以熔沸点甲烷<硅烷;
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |
故答案为:2H++NO3-+e-=NO2↑+H2O;正;铝在浓硝酸中发生钝化,氧化膜阻止了Al进一步发生反应,Al作正极,当硝酸浓度降为一定浓度时变为稀硝酸,Al开始做负极,电子流动方向发生改变.
点评 本题考查原子结构、元素周期律及原电池原理,为高频考点,侧重考查学生分析判断及知识的灵活运用能力,注意(4)题因为发生钝化现象而使Al开始做正极,反应到一定程度后Al作负极,为易错题.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
5.下列说法或对应关系中,正确的是( )
| A. | Fe比Cu的金属性强,因此可用FeCl3腐蚀Cu刻制应刷电路板 | |
| B. | 纯碱、小苏打、盐酸分别属于碱、盐、混合物 | |
| C. | 胶体化学是制造纳米材料的有效方法之一 | |
| D. | 用萃取方法分离碘的苯溶液 |
6.下列叙述正确的是( )
| A. | Na2O与Na2O2都是碱性氧化物 | |
| B. | 生石灰能与水反应,可用来干燥氨气 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 氯化铝是一种离子型电解质,可用于电解法制铝 |
3.能正确表示下列反应的离子方程式是( )
| A. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应,当SO42-完全沉淀时:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
10.二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.
在10L的密闭容器中按物质的量之比1:2充入CO和H2,若充有10molCO发生反应:CO(g)+2H2(g)?CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
(1)p2、T2时,0~lmin 内,平均速率ν(H2)=0.6mol/(L•min);
(2)你认为p1<p2(填“<”“>”或“=”)
(3)合成甲醇的反应为放热(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为Ka=Kb>Kc.
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有①③④⑤⑥.
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为-Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为:2CO2(g)=2CO(g)+O2(g)△H=+2(Q1-Q2)kJ/mol.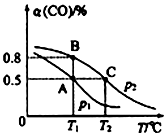
在10L的密闭容器中按物质的量之比1:2充入CO和H2,若充有10molCO发生反应:CO(g)+2H2(g)?CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(CO)/mol | 10 | 7 | 5 | 5 |
(2)你认为p1<p2(填“<”“>”或“=”)
(3)合成甲醇的反应为放热(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为Ka=Kb>Kc.
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有①③④⑤⑥.
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为-Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为:2CO2(g)=2CO(g)+O2(g)△H=+2(Q1-Q2)kJ/mol.

20.现有下列10种物质:
①液态氧 ②空气 ③Mg ④二氧化碳⑤H2SO4⑥Ca(OH)2⑦CuSO4•5H2O⑧牛奶 ⑨C2H5OH ⑩NaHCO3下列分类正确的是( )
①液态氧 ②空气 ③Mg ④二氧化碳⑤H2SO4⑥Ca(OH)2⑦CuSO4•5H2O⑧牛奶 ⑨C2H5OH ⑩NaHCO3下列分类正确的是( )
| A. | 属于混合物的是②⑦⑧ | B. | 属于盐的是⑥⑩ | ||
| C. | 属于电解质的是⑤⑥⑦⑩ | D. | 属于分散系的是②⑦⑧⑨ |
10.下列说法正确的是( )
| A. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)═2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为-a-b-c | |
| B. | 若2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 如图可表示水分解过程中的能量变化 |