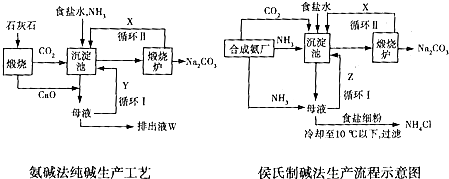
题目内容
7.已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色.针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选择在反应开始前是否加入B(填字母序号)做对比实验.A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
分析 影响反应速率的因素除了浓度、温度外,催化剂也影响反应速率;根据反应方程式可知,反应产物中锰离子随着反应的进行,浓度变化较大,反应前加入硫酸锰,根据反应速率大小判断锰离子是否在该反应中起到催化作用.
解答 解:对化学反应速率影响最快的是催化剂,故猜想还可能是催化剂的影响,
反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑中,浓度变化较大的为锰离子,所以选择的可以做催化剂的试剂应该含有锰离子,故只有B正确,
故答案为:Mn2+的催化作用; B.
点评 本题考查化学反应速率的影响因素,为高频考点,题目难度中等,影响化学反应速率的外界条件除温度、浓度、压强、催化剂外,还有很多因素可以改变反应速率,如光辐射、超声波、电弧、激光、强磁场、反应物颗粒大小等,探究单一条件对速率的影响时,要让此条件成为唯一变量.

练习册系列答案
相关题目
18.已知448℃时反应HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)的平衡常数是$\frac{1}{7}$,则H2(g)+I2(g)?2HI(g)在该温度下的平衡常数是( )
| A. | $\frac{1}{14}$ | B. | 14 | C. | $\frac{1}{49}$ | D. | 49 |
15.C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第三周期第IVA族.
(2)N原子的原子结构示意图为 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.
(3)用“>”或“<”填空:
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,t1时,原电池中电子流动方向发生改变,其原因是铝在浓硝酸中发生钝化,氧化膜阻止了Al进一步发生反应,Al作正极,当硝酸浓度降为一定浓度时变为稀硝酸,Al开始做负极,电子流动方向发生改变.
(1)Si位于元索周期表第三周期第IVA族.
(2)N原子的原子结构示意图为
 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,t1时,原电池中电子流动方向发生改变,其原因是铝在浓硝酸中发生钝化,氧化膜阻止了Al进一步发生反应,Al作正极,当硝酸浓度降为一定浓度时变为稀硝酸,Al开始做负极,电子流动方向发生改变.
12.能促进水的电离,并使溶液中c(H+)>c(OH-)的操作共有几项( )
①将水加热煮沸
②向水中投入一小块金属钠
③向水中通入CO2
④向水中通入NH3
⑤向水中加入明矾晶体
⑥向水中加入Na2CO3固体
⑦向水中加入NaHSO4固体.
①将水加热煮沸
②向水中投入一小块金属钠
③向水中通入CO2
④向水中通入NH3
⑤向水中加入明矾晶体
⑥向水中加入Na2CO3固体
⑦向水中加入NaHSO4固体.
| A. | 4项 | B. | 3项 | C. | 2项 | D. | 1项 |
4.向密闭容器中充入1.0mol CO和2.0mol H2O(g)发生反应:CO+H2O(g)?CO2+H2.当反应达平衡时,CO的转化率为α.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的转化率小于α的是( )
| A. | 0.5molCO+2.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| B. | 1.0molCO+2.0molH2O(g)+0.5molHe | |
| C. | 1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4mol H2 |
2.下列叙述不正确的是( )
| A. | 对于C(s)+H2O(g)?CO(g)+H2(g)反应,在一定条件下达到平衡,增加或减少C(s)的量平衡不移动 | |
| B. | 对于2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志 | |
| C. | 对于C(s)+CO2(g)?2CO(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志 | |
| D. | 对于I2(g)+H2(g)?2HI(g)反应,加入催化剂或增大压强均能缩短达到平衡所用时间,但HI的百分含量保持不变 |
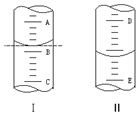 ①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL.
①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是5.2 mL.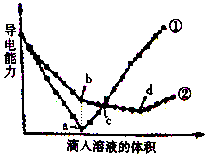 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.