题目内容
10.下列说法正确的是( )| A. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)═2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为-a-b-c | |
| B. | 若2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 如图可表示水分解过程中的能量变化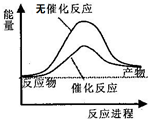 |
分析 A.焓变为反应物中键能之和减去生成物中键能之和;
B.CO不是稳定氧化物;
C.反应条件与反应中能量变化无关;
D.催化剂可降低反应所需的活化能.
解答 解:A.设断开1molH-Cl键所需的能量为x,由焓变为反应物中键能之和减去生成物中键能之和可知,b+c-2x=-a,解得x=$\frac{a+b+c}{2}$kJ,故A错误;
B.CO不是稳定氧化物,1molC生成稳定氧化物放热的热量大于110.5 kJ/mol,故B错误;
C.反应条件与反应中能量变化无关,则需要加热的反应可能是吸热反应或放热反应,常温下能发生的反应可能是放热反应或吸热反应,故C错误;
D.催化剂可降低反应所需的活化能,图中使用催化剂时活化能小,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系、燃烧热判断、催化剂对反应的影响等为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
15.C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第三周期第IVA族.
(2)N原子的原子结构示意图为 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.
(3)用“>”或“<”填空:
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,t1时,原电池中电子流动方向发生改变,其原因是铝在浓硝酸中发生钝化,氧化膜阻止了Al进一步发生反应,Al作正极,当硝酸浓度降为一定浓度时变为稀硝酸,Al开始做负极,电子流动方向发生改变.
(1)Si位于元索周期表第三周期第IVA族.
(2)N原子的原子结构示意图为
 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,t1时,原电池中电子流动方向发生改变,其原因是铝在浓硝酸中发生钝化,氧化膜阻止了Al进一步发生反应,Al作正极,当硝酸浓度降为一定浓度时变为稀硝酸,Al开始做负极,电子流动方向发生改变.
5.在恒温恒容的密闭容器中,充入4mol气体A和2mol气体B发生反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,反应前后体系压强之比为5:4.则下列说法正确的是( )
| A. | 气体A的平衡转化率大于气体B的平衡转化率 | |
| B. | 物质D的聚集状态一定是气体 | |
| C. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 | |
| D. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大 |
15.某温度下,密闭容器中发生反应aX(g)?bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质X的浓度是原来的1.8倍.则下列叙述正确的是( )
| A. | 可逆反应的化学计量数数:a>b+c | |
| B. | 压缩容器的容积时,v正增大,v逆减小 | |
| C. | 达到新平衡时,Y,Z浓度增大,K值变大 | |
| D. | 达到新平衡时,加入物质X反应正动,X的转化率增大 |
2.下列叙述不正确的是( )
| A. | 对于C(s)+H2O(g)?CO(g)+H2(g)反应,在一定条件下达到平衡,增加或减少C(s)的量平衡不移动 | |
| B. | 对于2SO2(g)+O2(g)?2SO3(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均不能作为达到化学平衡状态的标志 | |
| C. | 对于C(s)+CO2(g)?2CO(g)反应,当密度保持不变,在恒温恒容或恒温恒压条件下,均能作为达到化学平衡状态的标志 | |
| D. | 对于I2(g)+H2(g)?2HI(g)反应,加入催化剂或增大压强均能缩短达到平衡所用时间,但HI的百分含量保持不变 |
19.在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.85倍.下列叙述中错误的是( )
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率提高 |
20.对于平衡体系:mA(g)+nB(g)?pC(g)+qD(g),下列判断正确的是( )
| A. | 若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.55 倍,则m+n<p+q | |
| B. | 若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△H<0 | |
| C. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| D. | 若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 |
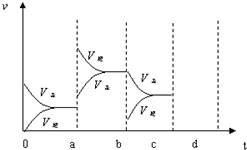 如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).
如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).