题目内容
10.二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.在10L的密闭容器中按物质的量之比1:2充入CO和H2,若充有10molCO发生反应:CO(g)+2H2(g)?CH3OH(g).
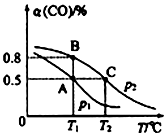
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(CO)/mol | 10 | 7 | 5 | 5 |
(2)你认为p1<p2(填“<”“>”或“=”)
(3)合成甲醇的反应为放热(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为Ka=Kb>Kc.
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有①③④⑤⑥.
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为-Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为:2CO2(g)=2CO(g)+O2(g)△H=+2(Q1-Q2)kJ/mol.
分析 (1)p2、T2时,0~lmin 内,CO的转化率是0.5,则参加反应的n(CO)=(10-7)mol=3mol,则v(CO)=$\frac{\frac{3mol}{10L}}{1min}$=0.3mol/(L.min),根据反应速率之比等于计量数之比计算ν(H2);
(2)相同温度下,该反应的正反应是反应前后气体体积减小的可逆反应,增大压强平衡正向移动,CO的转化率增大;
(3)升高温度平衡向吸热方向移动;
(4)能增加单位时间内CH3OH产量,说明增大正逆反应速率,可以通过增大反应物浓度、升高温度、加入催化剂、增大压强等方法实现;
(5)碳的燃烧热化学方程式为C(s)+O2(g)=CO2(g)△H=-Q1kJ/mol ①
碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为-Q2J/mol,其热化学方程式为:
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-Q2kJ/mol ②
将方程式2(②-①)得2CO2(g)=2CO(g)+O2(g)△H进行相应的改变.
解答 解:(1)p2、T2时,0~lmin 内,CO的转化率是0.5,则参加反应的n(CO)=(10-7)mol=3mol,则v(CO)=$\frac{\frac{3mol}{10L}}{1min}$=0.3mol/(L.min),根据反应速率之比等于计量数之比计算ν(H2)=2v(CO)=2×0.3mol/(L.min)=0.6mol/(L.min),
故答案为:0.6;
(2)相同温度下,该反应的正反应是反应前后气体体积减小的可逆反应,增大压强平衡正向移动,CO的转化率增大,根据图知,相同温度下CO的转化率P1<P2,故答案为:<;
(3)升高温度,CO的转化率降低,说明平衡逆向移动,则正反应是放热反应,所以△H<0,
该反应的正反应是放热反应,升高温度平衡常数减小,AB温度相同且小于C,所以平衡常数Ka=Kb>Kc,
故答案为:放热;Ka=Kb>Kc;
(4)能增加单位时间内CH3OH产量,说明增大正逆反应速率,可以通过增大反应物浓度、减小生成物浓度、升高温度、加入催化剂、增大压强等方法实现,
故选①③④⑤⑥;
(5)碳的燃烧热化学方程式为C(s)+O2(g)=CO2(g)△H=-Q1kJ/mol ①
碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为-Q2J/mol,其热化学方程式为C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-Q2kJ/mol ②
将方程式2(②-①)得2CO2(g)=2CO(g)+O2(g)△H=+2(Q1-Q2)kJ/mol,
故答案为:2CO2(g)=2CO(g)+O2(g)△H=+2(Q1-Q2)kJ/mol.
点评 本题考查化学平衡计算、盖斯定律、化学平衡影响因素等知识点,侧重考查学生分析判断及计算能力,注意:化学平衡常数只与温度有关,与物质浓度等因素都无关,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | Ksp的数值只与温度有关 | |
| B. | Ksp的数值只与难溶电解质的性质和温度有关 | |
| C. | Ksp的大小与沉淀量有多少和溶液中离子浓度的大小有关 | |
| D. | Ksp的数值越大,电解质在水中的溶解能力越强 |
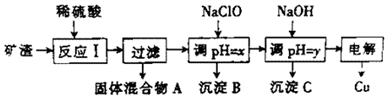
已知:①Cu2O+2H+═Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)y的数值范围是5.2≤pH<5.4.
(3)以上步骤中的NaOH可以用AC代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为Cl2、O2.
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.
| A. | $\frac{1}{14}$ | B. | 14 | C. | $\frac{1}{49}$ | D. | 49 |
(1)Si位于元索周期表第三周期第IVA族.
(2)N原子的原子结构示意图为
 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,t1时,原电池中电子流动方向发生改变,其原因是铝在浓硝酸中发生钝化,氧化膜阻止了Al进一步发生反应,Al作正极,当硝酸浓度降为一定浓度时变为稀硝酸,Al开始做负极,电子流动方向发生改变.
| A. | 0.5molCO+2.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| B. | 1.0molCO+2.0molH2O(g)+0.5molHe | |
| C. | 1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4mol H2 |
| A. | 气体A的平衡转化率大于气体B的平衡转化率 | |
| B. | 物质D的聚集状态一定是气体 | |
| C. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 | |
| D. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大 |
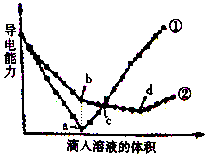 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴人溶液体积变化的曲线如图所示.