题目内容
9.BaCO3分别加入:①30mL水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和.请确定各溶液中Ba2+的浓度由大到小的顺序为:③④①②.分析 碳酸钡饱和溶液中存在BaCO3(s)?Ba2+(aq )+CO32-(aq),c(CO32-)可影响平衡的移动,c(CO32-)越小,Ba2+的浓度越大,根据选项中的物质中的离子对碳酸钡的溶解是促进还是抑制来分析Ba2+的浓度.
解答 解:①BaCO3加入30mL水中,充分溶解至溶液饱和存在:BaCO3(s)?Ba2+(aq )+CO32-(aq),则溶液中存在一定浓度的Ba2+,但浓度较小;
②将足量BaCO3加入10mL 0.2mol/L Na2CO3溶液中,由于碳酸根离子的浓度较大,抑制碳酸钡的溶解,则Ba2+的浓度很小;
③将足量BaCO3加入50mL 0.01mol/L氯化钡溶液中,氯化钡电离产生0.01mol/LBa2+,则Ba2+的浓度较大;
④将足量BaCO3加入100mL0.01mol/L盐酸中,碳酸钡与盐酸反应生成0.005mol/LBa2+,则Ba2+的浓度较大;
所以Ba2+的浓度由大到小的顺序为:③>④>①>②,
故答案为:③④①②.
点评 本题考查了溶液中离子浓度大小比较,为高频考点,侧重于平衡移动原理的应用的考查,注意把握难容电解质的溶解平衡的移动,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
14.向KOH溶液中通入8.96L(标准状况)氯气恰好完全反应生成三种含氯盐:0.6molKCl、0.1molKClO和X.则X是( )
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.1molKClO2 | D. | 0.2molKClO |
15.C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元索周期表第三周期第IVA族.
(2)N原子的原子结构示意图为 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.
(3)用“>”或“<”填空:
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生.

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,t1时,原电池中电子流动方向发生改变,其原因是铝在浓硝酸中发生钝化,氧化膜阻止了Al进一步发生反应,Al作正极,当硝酸浓度降为一定浓度时变为稀硝酸,Al开始做负极,电子流动方向发生改变.
(1)Si位于元索周期表第三周期第IVA族.
(2)N原子的原子结构示意图为
 ;Cu的低价氧化物的颜色为砖红色.
;Cu的低价氧化物的颜色为砖红色.(3)用“>”或“<”填空:
| 原子半径 | 电负性 | 熔点 | 沸点 |
| Al>Si | N<O | 金刚石>晶体硅 | CH4<SiH4 |

0-t1时,原电池的负极是Al片,此时,正极的电极反应式是2H++NO3-+e-=NO2↑+H2O,溶液中的H+向正极移动,t1时,原电池中电子流动方向发生改变,其原因是铝在浓硝酸中发生钝化,氧化膜阻止了Al进一步发生反应,Al作正极,当硝酸浓度降为一定浓度时变为稀硝酸,Al开始做负极,电子流动方向发生改变.
12.能促进水的电离,并使溶液中c(H+)>c(OH-)的操作共有几项( )
①将水加热煮沸
②向水中投入一小块金属钠
③向水中通入CO2
④向水中通入NH3
⑤向水中加入明矾晶体
⑥向水中加入Na2CO3固体
⑦向水中加入NaHSO4固体.
①将水加热煮沸
②向水中投入一小块金属钠
③向水中通入CO2
④向水中通入NH3
⑤向水中加入明矾晶体
⑥向水中加入Na2CO3固体
⑦向水中加入NaHSO4固体.
| A. | 4项 | B. | 3项 | C. | 2项 | D. | 1项 |
4.向密闭容器中充入1.0mol CO和2.0mol H2O(g)发生反应:CO+H2O(g)?CO2+H2.当反应达平衡时,CO的转化率为α.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的转化率小于α的是( )
| A. | 0.5molCO+2.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| B. | 1.0molCO+2.0molH2O(g)+0.5molHe | |
| C. | 1.0molCO+1.0molH2O(g)+1.0molCO2+1.0mol H2 | |
| D. | 0.5molCO+1.5molH2O(g)+0.4molCO2+0.4mol H2 |
19.在密闭容器中发生如下反应:aX(g)+bY(g)?cZ(g)+dW(g),反应达平衡后保持温度不变,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡时的1.85倍.下列叙述中错误的是( )
| A. | 平衡向逆反应方向移动 | B. | a+b<c+d | ||
| C. | Z的体积分数增加 | D. | X的转化率提高 |
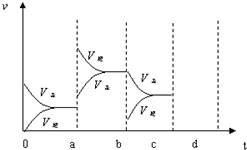 如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).
如图表示在密闭容器中反应:2SO2+O2?2SO3△H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小生成物 SO3 的浓度; 若增大压强时,反应速度变化情况画在c~d处.以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).以上反应达平衡后,若此时只将容器的体积扩大为原来的2倍,达新平衡时,容器内温度将(容器不与外界进行热交换,填“升高”或“降低”);达新平衡时,容器内混合气体的平均相对分子质量比原平衡时(填“增大”、“减小”或“相等”).