题目内容
将Cl2通入NaOH溶液中,反应得到NaCl,NaClO3,NaClO的混合溶液,其中ClO-、ClO3-的浓度比为1:3,则Cl2与NaOH反应时,被还原的氯元素和被氧化的氯元素的物质的量的比是( )
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:Cl2生成ClO-与ClO3-是被氧化的过程,Cl2生成NaCl是被还原的过程,氧化还原反应中氧化剂和还原剂之间得失电子数目相等,根据ClO-与ClO3-的物质的量浓度之比可计算失去电子的总物质的量,进而可计算得到电子的总物质的量,可计算被还原的氯元素的物质的量,则可计算被还原的氯元素和被氧化的氯元素的物质的量之比.
解答:
解:Cl2生成ClO-与ClO3-是被氧化的过程,化合价分别由0价升高为+1价和+5价,
ClO-与ClO3-的物质的量浓度之比为1:3,
则可设ClO-为1mol,ClO3-为3mol,被氧化的Cl共为4mol,
失去电子的总物质的量为1mol×(1-0)+3mol×(5-0)=16mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成NaCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为16mol,
则被还原的Cl的物质的量为16mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为16mol:4mol=4:1,
故选D.
ClO-与ClO3-的物质的量浓度之比为1:3,
则可设ClO-为1mol,ClO3-为3mol,被氧化的Cl共为4mol,
失去电子的总物质的量为1mol×(1-0)+3mol×(5-0)=16mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成NaCl是被还原的过程,化合价由0价降低为-1价,
则得到电子的物质的量也应为16mol,
则被还原的Cl的物质的量为16mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为16mol:4mol=4:1,
故选D.
点评:本题考查氧化还原反应的计算,题目难度不大,本题注意从氧化还原反应中氧化剂和还原剂之间得失电子数目相等的角度计算,注意守恒法的利用.

练习册系列答案
相关题目
某粒子的结构示意图为 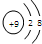 该粒子的说法不正确的是( )
该粒子的说法不正确的是( )
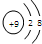 该粒子的说法不正确的是( )
该粒子的说法不正确的是( )| A、核电荷数为9 |
| B、核外有两个电子层 |
| C、属于阴离子 |
| D、在化学反应中容易得到1个电子 |
用NA表示阿伏加德罗常数的数值,下列说法中正确的是( )
| A、在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA |
| B、22.4L NH3中含有的原子总数为4NA |
| C、1mol单质钠在常温下或点燃条件下与O2完全反应转移的电子数都为NA |
| D、常温条件下,等物质的量浓度的HCl溶液和NaOH溶液混合,溶液pH=7 |
下列说法正确的是( )
| A、1molCH4与Cl2发生取代反应最多消耗2molCl2 | ||
| B、乙酸乙酯的水解属于取代反应 | ||
C、CH3-CH═CH2+Cl2
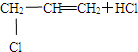 属于加成反应 属于加成反应 | ||
D、甲苯硝化生成三硝基甲苯的化学方程式 |
某烃的结构简式为 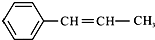 ,它可能具有的性质是( )
,它可能具有的性质是( )
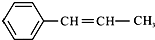 ,它可能具有的性质是( )
,它可能具有的性质是( )| A、能与H2发生加成反应,且需要1 mol H2 |
| B、分子里所有的原子都处在同一平面上 |
C、能发生加聚反应,其加聚产物可用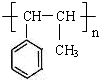 表示 表示 |
| D、该烃和苯互为同系物 |