题目内容
有一包铁粉和铜粉混合物均匀的粉末样品,为了确定其组成,某同学将不同质量的该样品分别与40mL1mol?L-1的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化).
下列实验结论不正确的是( )
| 实验序号 | 一 | 二 | 三 | 四 |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
| A、实验一反应后溶液中含有Fe3+、Fe2+、Cu2+ |
| B、实验二、三反应后剩余固体全部是Cu |
| C、实验四的滤液中c(Fe2+)=1.5mol?L-1 |
| D、原粉末样品中m(Fe):m(Cu)=7:8 |
考点:有关混合物反应的计算
专题:计算题
分析:铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol?L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu;
第③组实验中溶解金属为3.60g-2.48g=1.12g,混合物中Fe恰好完全反应、Cu不反应,剩余2.48g为Cu,即3.60g混合物中Cu的质量为2.48g,则混合物中m(Fe):m(Cu)=1.12g:2.48g=14:31;
故第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2;据此分别分析各选项选择即可.
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol?L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu;
第③组实验中溶解金属为3.60g-2.48g=1.12g,混合物中Fe恰好完全反应、Cu不反应,剩余2.48g为Cu,即3.60g混合物中Cu的质量为2.48g,则混合物中m(Fe):m(Cu)=1.12g:2.48g=14:31;
故第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2;据此分别分析各选项选择即可.
解答:
解:铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol?L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu;
第③组实验中溶解金属为3.60g-2.48g=1.12g,混合物中Fe恰好完全反应、Cu不反应,剩余2.48g为Cu,即3.60g混合物中Cu的质量为2.48g,则混合物中m(Fe):m(Cu)=1.12g:2.48g=14:31;
故第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2;
A、依据分析可知,实验一反应后溶液中含有Fe3+、Fe2+、Cu2+,故A正确;
B、依据分析可知:实验二、三反应后剩余固体全部是Cu,故B正确;
C、第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2,则溶液中存在c(Fe2+)=
c(Cl-)=
c(FeCl3)=
×1mol/L=1.5 mol/L,故C正确;
D、第③组实验中溶解金属为3.60g-2.48g=1.12g,混合物中Fe恰好完全反应、Cu不反应,剩余2.48g为Cu,即3.60g混合物中Cu的质量为2.48g,则混合物中m(Fe):m(Cu)=1.12g:2.48g=14:31,故D错误;
故选D.
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol?L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu;
第③组实验中溶解金属为3.60g-2.48g=1.12g,混合物中Fe恰好完全反应、Cu不反应,剩余2.48g为Cu,即3.60g混合物中Cu的质量为2.48g,则混合物中m(Fe):m(Cu)=1.12g:2.48g=14:31;
故第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2;
A、依据分析可知,实验一反应后溶液中含有Fe3+、Fe2+、Cu2+,故A正确;
B、依据分析可知:实验二、三反应后剩余固体全部是Cu,故B正确;
C、第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2,则溶液中存在c(Fe2+)=
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
D、第③组实验中溶解金属为3.60g-2.48g=1.12g,混合物中Fe恰好完全反应、Cu不反应,剩余2.48g为Cu,即3.60g混合物中Cu的质量为2.48g,则混合物中m(Fe):m(Cu)=1.12g:2.48g=14:31,故D错误;
故选D.
点评:本题考查混合物的计算,明确物质反应先后顺序及各组剩余固体成分是解本题关键,再结合转移电子守恒、原子守恒进行解答,同时考查学生思维缜密性,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列物质熔点比较错误的( )
| A、Na<Mg<Al |
| B、Br2<Cl2<I2 |
| C、硅<碳化硅<金刚石 |
| D、AlCl3<KCl<NaCl |
NA代表阿伏加德罗常数,下列叙述错误的是( )
| A、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% |
| B、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移电子个数为2moL |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、某无色溶液中通入Cl2,溶液变为棕黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I- |
下列说法正确的是( )
| A、1molCH4与Cl2发生取代反应最多消耗2molCl2 | ||
| B、乙酸乙酯的水解属于取代反应 | ||
C、CH3-CH═CH2+Cl2
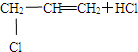 属于加成反应 属于加成反应 | ||
D、甲苯硝化生成三硝基甲苯的化学方程式 |
下列说法正确的是( )
| A、水加热到很高的温度都难分解是因为水分子中存在氢键 |
| B、蔗糖、淀粉、蛋白质及其水解产物均为非电解质 |
| C、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D、不用任何试剂即可鉴别Na2CO3溶液和NaHSO4溶液. |