题目内容
下列关于实验现象的描述不正确的是( )
| A、把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 |
| B、实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快 |
| C、把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
考点:原电池和电解池的工作原理,化学反应速率的影响因素,铁盐和亚铁盐的相互转变
专题:
分析:A、形成了铁铜原电池,氢离子在正极的电子;
B、形成了铜石墨原电池,加快反应速率;
C、铜与铁离子反应生成铁离子和亚铁离子,不可能生成铁;
D、锌与铜离子反应生成铜,形成了锌铜原电池,反应速率加快.
B、形成了铜石墨原电池,加快反应速率;
C、铜与铁离子反应生成铁离子和亚铁离子,不可能生成铁;
D、锌与铜离子反应生成铜,形成了锌铜原电池,反应速率加快.
解答:
解:A、铁为负极,铜为正极,氢离子在正极铜片上得电子生成氢气,故A正确;
B、形成了铜石墨原电池,加快反应速率,故B正确;
C、铜与铁离子反应生成铁离子和亚铁离子,不可能生成铁,故C错误;
D、锌与铜离子反应生成铜,形成了锌铜原电池,反应速率加快,气泡放出速率加快,故D正确;
故选C.
B、形成了铜石墨原电池,加快反应速率,故B正确;
C、铜与铁离子反应生成铁离子和亚铁离子,不可能生成铁,故C错误;
D、锌与铜离子反应生成铜,形成了锌铜原电池,反应速率加快,气泡放出速率加快,故D正确;
故选C.
点评:本题考查了原电池加快反应速率的原理,氧化还原反应产物的判断,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是( )
| A、c(H+)?c(OH-)>1×10-14 |
| B、c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C、c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
下列物质熔点比较错误的( )
| A、Na<Mg<Al |
| B、Br2<Cl2<I2 |
| C、硅<碳化硅<金刚石 |
| D、AlCl3<KCl<NaCl |
在一密闭容器中加入一定物质的量的A气体,发生 a A(g)?b B(g)+c C(g)反应,达平衡后,保持温度不变,将容器体积扩大为原来的一倍,当达到新的平衡时c(A)变为原平衡的40%,下列说法正确的是( )
| A、化学计量数之间的关系:a>b+c |
| B、物质B的体积分数减小 |
| C、平衡向正反应方向移动 |
| D、平衡移动过程中,与原平衡相比v正增大、v逆减小 |
下列说法不正确的是( )
| A、使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 |
| B、石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
| C、向汽油中添加甲醇后,该混合燃料的热值不变 |
| D、利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学方法 |
某粒子的结构示意图为  该粒子的说法不正确的是( )
该粒子的说法不正确的是( )
 该粒子的说法不正确的是( )
该粒子的说法不正确的是( )| A、核电荷数为9 |
| B、核外有两个电子层 |
| C、属于阴离子 |
| D、在化学反应中容易得到1个电子 |
NA代表阿伏加德罗常数,下列叙述错误的是( )
| A、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% |
| B、在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移电子个数为2moL |
| C、标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g |
| D、某无色溶液中通入Cl2,溶液变为棕黄色,再加入淀粉溶液,溶液变为蓝色,说明原溶液中存在I- |
下列说法正确的是( )
| A、1molCH4与Cl2发生取代反应最多消耗2molCl2 | ||
| B、乙酸乙酯的水解属于取代反应 | ||
C、CH3-CH═CH2+Cl2
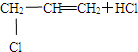 属于加成反应 属于加成反应 | ||
D、甲苯硝化生成三硝基甲苯的化学方程式 |