题目内容
4.在一密闭容器中有如下反应:mA(g)+nB(g)?pC(g)△H.某化学兴趣小组根据此反应在不同条件下的实验数据,作出了如图曲线图: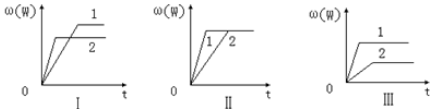
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
分析 图Ⅰ可能是不同压强、温度对反应的影响,如是压强,应有P2>P1,m+n<p;如是温度,应为T2>T1,△H<0;
图Ⅱ可能是在同温同压下催化剂对反应的影响,也可能是同温下改变压强的影响,应p1>p2,m+n=p;
图Ⅲ可能是不同压强、温度对反应的影响,如是压强,应有P1>P2,m+n>p;如是温度,应为T1>T2,△H>0,以此解答该题.
解答 解:A.图Ⅰ如是压强对反应的影响,则P2>P1,增大压强,ω(C)减小,说明平衡向逆反应方向移动,则m+n<p,故A正确;
B.图Ⅱ如是压强对反应的影响,则P1>P2,增大压强,ω(C)不变,平衡不移动,则m+n=p,故B正确;
C.图Ⅲ如是温度对反应的影响,应有T1>T2,升高温度,ω(C)增大,平衡向正反应方向移动,则△H>0,故C错误;
D.若m+n<p,△H>0,则该反应在高温下容易自发进行,故D错误;
故选AB.
点评 本题考查化学平衡图象问题,题目难度中等,本题注意把握图象中曲线的变化特点,结合外界条件对平衡移动的影响分析.

练习册系列答案
相关题目
14.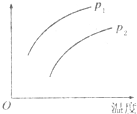 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )| A. | P1>P2,纵坐标指C的质量分数 | |
| B. | P1<P2,纵坐标指A的质量分数 | |
| C. | P1<P2.纵坐标指A的转化率 | |
| D. | P1<P2,纵坐标指混合气体的平均摩尔质量 |
19.在密闭容器中发生可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )
| A. | v(O2)=0.01 mol•L-1•s-1 | B. | v(NH3)=0.02mol•L-1•s-1 | ||
| C. | v(H2O)=0.06 mol•L-1•min-1 | D. | v(NO)=0.03mol•L-1•s-1 |
9.煤和煤制品(如水煤气、焦炭、甲醚等)已广泛应用于工农业生产中.
(1)已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ.mol-l
CO2(g)+H2(g)=CO(g)+H2O(g)△H=+41.3kJ.mol-l
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90.0kJ.mol-1,该反应在高温(填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
(2)利用炭还原法可处理氮氧化物(如NO等),发生的反应为C(s)+2NO(g)?N2(g)+CO2 (g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如表所示:
①10~20min内,N2的平均反应速率可v(N2)=0.009mol.L-l.min-l.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是AD(填字母).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.遁当缩小容器的体积
(3)研究表明,反应CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol•L-l,在该条件下达到平衡时,CO的转化率为75%.
(1)已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ.mol-l
CO2(g)+H2(g)=CO(g)+H2O(g)△H=+41.3kJ.mol-l
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90.0kJ.mol-1,该反应在高温(填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
(2)利用炭还原法可处理氮氧化物(如NO等),发生的反应为C(s)+2NO(g)?N2(g)+CO2 (g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如表所示:
| 时间(min) 浓度(mol•L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是AD(填字母).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.遁当缩小容器的体积
(3)研究表明,反应CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
13.常温时由水电离产生的c(H+)=1×10-14 mol•L-1的溶液中,一定不能大量共存的离子组是( )
| A. | Al3+ NH4+ Br- SO42- | B. | Na+ Fe2+ Cl- NO3- | ||
| C. | K+ Ba2+ Cl- NO3- | D. | K+ Na+ SO42- SO32- |
 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容: