题目内容
13.常温时由水电离产生的c(H+)=1×10-14 mol•L-1的溶液中,一定不能大量共存的离子组是( )| A. | Al3+ NH4+ Br- SO42- | B. | Na+ Fe2+ Cl- NO3- | ||
| C. | K+ Ba2+ Cl- NO3- | D. | K+ Na+ SO42- SO32- |
分析 由水电离产生的c(H+)=1×10-14 mol•L-1的溶液,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.碱溶液中不能大量存在Al3+、NH4+,酸溶液中该组离子之间不反应,故A不选;
B.碱溶液中不能大量存在Fe2+,酸溶液中H+、Fe2+、NO3-发生氧化还原反应,故B选;
C.酸、碱溶液中该组离子之间不反应,可大量共存,故C不选;
D.碱溶液中该组离子之间不反应,可大量共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
3.用标准浓度的盐酸来滴定锥形瓶中放置时间较长的氢氧化钠溶液,应选用的指示剂及滴定终点颜色变化的情况最好是( )
| A. | 石蕊,由蓝变红 | B. | 酚酞,红色褪去 | C. | 甲基橙,由黄变橙 | D. | 甲基橙,由橙变黄 |
4.在一密闭容器中有如下反应:mA(g)+nB(g)?pC(g)△H.某化学兴趣小组根据此反应在不同条件下的实验数据,作出了如图曲线图:
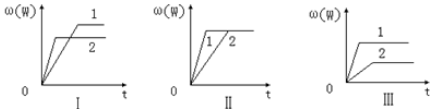
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
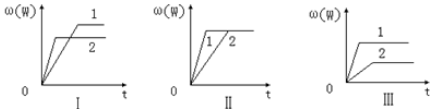
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
18.不同温度下水的离子积常数如表所示:
①请用文字解释随温度升高水的离子积增大的原因:水电离吸热,升高温度后平衡正向移动
②25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为1.0×10-10mol/L
③10℃时纯水的电离平衡常数为5.3×10-17.
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.00 | 2.92 | 5.47 | 55.0 |
②25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为1.0×10-10mol/L
③10℃时纯水的电离平衡常数为5.3×10-17.
5.下列各组物质:①NaCl和NaNO3②CaCO3和BaCl2③KCl和MnO2④BaSO4和AgCl按溶解、过滤、蒸发的操作顺序能将它们一一分离的是( )
| A. | 只有① | B. | ③和④ | C. | ②和③ | D. | 只有③ |
15.向AgCl沉淀中加入过量的KI溶液,白色沉淀转化为黄色沉淀.下列叙述错误的是( )
| A. | 加入过量的KI溶液充分反应后,Kw(AgCl)减小 | |
| B. | 加入过量的KI溶液充分反应后,溶液中Ag+和I-的浓度之积等于Ksp(AgI) | |
| C. | 加入过量的KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积等于Ksp(AgCl) | |
| D. | Ksp(AgI)<Ksp(AgCl) |