题目内容
12.用Na2CO3•l0H2O晶体,配制0.1mol/L的咖Na2CO3溶液480mL.配制时涉及到如下操作:①轻轻振荡容量瓶(震荡时不能将溶液溢出刻度线以上),使溶液充分混合
②用天平称量纯净的Na2CO3•l0H2O晶体14.3g
③待烧杯中的溶液冷却后沿玻璃棒小心地注入500mL容量瓶
④将容量瓶用瓶塞盖好,反复上下颠倒、摇匀
⑤将配制好的溶液倒入干燥、洁净的试剂瓶中,贴好标签备用
⑥将称好的固体放入烧杯中,加入适量的蒸馏水使固体完全溶解
⑦改用胶头滴管加蒸馏水至溶液的凹液面与刻度线相切
⑧用蒸馏水洗涤烧杯内壁2-3次,将每次洗涤后的溶液也都注入容量瓶中
⑨向容量瓶中注入蒸馏水,直到容量瓶中的液面接近容量瓶刻度线1cm~2cm处
②14.3,③500mL容量瓶,⑦胶头滴管.
(2)在下列选项中选择正确的操作顺序B.
A.②⑥③④①⑦⑧⑨⑤B.②⑥③⑧①⑨⑦④⑤
C.②③①④⑥⑦⑧⑨⑤D.②③①⑥⑦⑧⑨④⑤
(3)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3,10H2O晶体准确称量后,失去了部分结晶水再溶解
②容量瓶未干燥用来配制溶液
③转移溶液后,未洗涤烧杯和玻璃棒
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
⑤定容时俯视刻度线
⑥固体溶解后,未等溶液冷却至室温立即转移到容量瓶定容
其中引起所配溶液浓度偏高的有⑤⑥(填序号)
(4)容量瓶所具备的功能有A
A.配制某浓度的稀硫酸 B.测量溶液的体积C.用来溶解固体溶质 D.长期贮存溶液.
分析 (1)依据m=CVM计算需要溶质的质量;
依据配制溶液体积选择合适规格的容量瓶,在容量瓶中配制溶液;
定容时,加蒸馏水到离刻度线1-2cm,改用胶头滴管逐滴滴加;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,据此排序;
(3)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(4)容量瓶为配制一定体积、一定物质的量浓度溶液的专用精密仪器,不能用来加热、不能用于溶解固体,稀释浓溶液,不能用来长期存储液体,据此解答.
解答 解:(1)用Na2CO3•l0H2O晶体,配制0.1mol/L的咖Na2CO3溶液480mL,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=0.1mol/L×286g/mol×0.5L=14.3;
待烧杯中的溶液冷却后沿玻璃棒小心地注入500mL容量瓶;
定容时,加蒸馏水到离刻度线1-2cm,改用胶头滴管逐滴滴加;
故答案为:14.3;500mL容量瓶;胶头滴管;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的顺序为:②⑥③⑧①⑨⑦④⑤,故选:B;
故答案为:B;
(3)①Na2CO3•10H2O晶体准确称量后,失去了部分结晶水再溶解,对溶质的物质的量和溶液体积无影响,溶液浓度不变,故不选;
②容量瓶未干燥用来配制溶液,对溶质的物质的量和溶液体积无影响,溶液浓度不变,故不选;
③转移溶液后,未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故不选;
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故不选;
⑤定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选;
⑥固体溶解后,未等溶液冷却至室温立即转移到容量瓶定容,冷却后液面下降,溶液浓度偏高,故选;
故选:⑤⑥;
(4)容量瓶为配制一定体积、一定物质的量浓度溶液的专用精密仪器,不能用来加热、不能用于溶解固体,稀释浓溶液,不能用来长期存储液体,
故 选:A.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤,熟悉容量瓶构造及使用方法和注意问题是解题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 石蕊,由蓝变红 | B. | 酚酞,红色褪去 | C. | 甲基橙,由黄变橙 | D. | 甲基橙,由橙变黄 |
| A. | 通入22.4LSO2参加反应时,有2 NA个电子发生转移 | |
| B. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 | |
| C. | 滴加KI溶液时,KI被氧化,CuI是氧化产物 | |
| D. | 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充人2mol N2和6molH2,达平衡后放出的热量为Q2 kJ,则Q2>(填“>”、“<”或“=”)2Q1.
③已知:

1mol N-H键断裂吸收的能量约等于391kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2 (g)+3H2(g)?2NH3 (g),其平衡常数K与温度T的关系如表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②一定温度下,下列各项能作为判断该反应达到化学平衡状态的依据是bc(填字母).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.浓度商Q=平衡常数K
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应处于(填“处于”或“不处于”)平衡状态.
| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | NH3通入A1C13溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
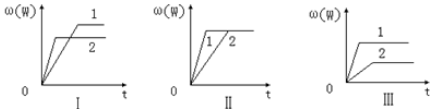
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
| A. | 加入过量的KI溶液充分反应后,Kw(AgCl)减小 | |
| B. | 加入过量的KI溶液充分反应后,溶液中Ag+和I-的浓度之积等于Ksp(AgI) | |
| C. | 加入过量的KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积等于Ksp(AgCl) | |
| D. | Ksp(AgI)<Ksp(AgCl) |