题目内容
7.根据下列叙述写出相应的热化学方程式或反应热:(1)1.0克乙醇完全燃烧生成液态水放热29.72kJC2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1(热化学方程式)
(2)SiH4是一种无色气体,在空气中爆炸性自燃,生成SiO2和H2O(l),己知室温下1克SiH4自燃放热44.6kJSiH4(g)+2O2(g)=SiO2(g)+2H2O(l);△H=-1427.2kJ/mol(热化学方程式)
(3)0.3mol气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态的B2O3和液态水,放出649.5kJ热量,表示其燃烧热的热化学方程式为B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol
(4)已知常温常压下拆开 1mol H-H键、1mol N-H键、1mol N≡N 键分别需要的能量是436kJ、391kJ、946kJ,则常温常压时,N2与H2反应生成 NH3的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1.
(5)已知碳的燃烧热△H1=a kJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H2=b kJ•mol-1
S(s)+2K(s)═K2S(s)△H3=c kJ•mol-1
则 S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=(3a+b-c)kJ•mol-1.
分析 (1)依据1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,计算求出1mol乙醇完全燃烧放出的热量,然后根据热化学方程式书写方法写出热化学方程式,标注物质聚集状态和对应反应的焓变;
(2)根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(3)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,根据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量写出其燃烧热的热化学反应方程式;
(4)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(5)①C(S)+O2(g )=CO2(g)△H1=a kJ•mol-1
②2K(s)+N2(g)+3O2(g)═2KNO3(s)△H2=b kJ•mol-1
③S(s)+2K(s)═K2S(s)△H3=c kJ•mol-1
3×①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),依据盖斯定律计算反应热.
解答 解:(1)1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,则1mol乙醇的质量=1mol×46g/mol=46g,完全燃烧生成稳定的氧化物放出的热量为46×29.7kJ=1366.2kJ,其反应的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1,
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1;
(2)n(SiH4)=$\frac{1g}{32g/mol}$=$\frac{1}{32}$mol,则1molSiH4燃烧放出的热量为:44.6kJ×32=1427.2kJ,
反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+2O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol;
(3)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,燃烧热的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
故答案为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;
(4)在反应N2+3H2?2NH3中,断裂3molH-H键,1molN三N键共吸收的能量为3×436kJ+946kJ=2254kJ,生成2molNH3,共形成6molN-H键,放出的能量为6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为2346kJ-2254kJ=92kJ,N2与H2反应生成NH3的热化学方程式为,N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
(5))①C(S)+O2(g )=CO2(g)△H1=a kJ•mol-1
②2K(s)+N2(g)+3O2(g)═2KNO3(s)△H2=b kJ•mol-1
③S(s)+2K(s)═K2S(s)△H3=c kJ•mol-1
3×①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),依据盖斯定律可知该反应的反应热为:3△H1+△H2-△H3=(3a+b-c)kJ•mol-1;
故答案为:(3a+b-c)kJ•mol-1;
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

 考前必练系列答案
考前必练系列答案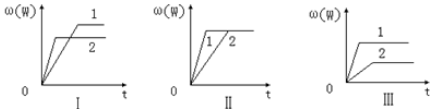
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
| A. | 只有① | B. | ③和④ | C. | ②和③ | D. | 只有③ |
| A. | 加入过量的KI溶液充分反应后,Kw(AgCl)减小 | |
| B. | 加入过量的KI溶液充分反应后,溶液中Ag+和I-的浓度之积等于Ksp(AgI) | |
| C. | 加入过量的KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积等于Ksp(AgCl) | |
| D. | Ksp(AgI)<Ksp(AgCl) |
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |

| A. | 0~6 min内,反应的平均速率v(Cl2)=0.15 mol•L-1•min -1 | |
| B. | 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动 | |
| C. | 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)>T(15) | |
| D. | 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同 |
①氢解反应:COS(g)+H2(g)═H2S(g)+CO(g)△H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)═H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如下:
| 化学键 | C═O(CO2) | C═O(COS) | C═S | H-S | H-O |
| E(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
(1)在以上脱硫除羰基硫(O═C═S)的反应中,若某反应有4mol电子发生转移,则该反应吸收热量为14kJ,△H2═-35kJ/mol,
(2)CO和H2O(g)能反应生成CO2和H2,写出此反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H═-42kJ/mol.
(3)羰基硫的氢解或水解反应可否设计成原电池否(填“是”或“否”)理由是氢解反应是吸热反应,水解反应是非氧化还原反应.
(4)研究表明,用金属储氢材料(MH)、白金(Pt)、硫酸溶液组成的原电池可以使羰基硫脱硫处理.
①原电池的负极材料是MH(填化学式)
②写出原电池的正极反应式COS+2e-+2H+═CO↑+H2S
③原电池工作时,电流的流动方向是Pt→导线→MH,当电路中有2mol电子流过时能够处理羰基硫(COS)22.4L(标准状况下).
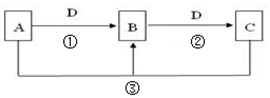 常见无机物A、B、C、D存在如图转化关系:
常见无机物A、B、C、D存在如图转化关系: