题目内容
19.在密闭容器中发生可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),以下是不同情况下的反应速率,其中最快的是( )| A. | v(O2)=0.01 mol•L-1•s-1 | B. | v(NH3)=0.02mol•L-1•s-1 | ||
| C. | v(H2O)=0.06 mol•L-1•min-1 | D. | v(NO)=0.03mol•L-1•s-1 |
分析 在单位相同的条件下,化学反应速率与其计量数的比值越大,该反应速率越快,据此分析解答.
解答 解:A.$\frac{v({O}_{2})}{5}$=$\frac{0.01}{5}$mol•L-1•s-1=0.002mol•L-1•s-1=0.12mol•L-1•min-1,
B.$\frac{v(N{H}_{3})}{4}$=$\frac{0.02}{4}$mol•L-1•s-1=0.005mol•L-1•s-1=0.3mol•L-1•min-1;
C.$\frac{v({H}_{2}O)}{6}$=$\frac{0.06}{6}$mol•L-1•min-1=0.01mol•L-1•min-1;
D.$\frac{v(NO)}{4}$=$\frac{0.03}{4}$×60mol•L-1•min-1=0.45mol•L-1•min-1;
通过以上分析知,反应速率快慢顺序是D>B>A>C,所以最快的是D,
故选D.
点评 本题考查化学反应速率大小比较,在比较反应速率快慢之前单位要统一,再根据化学反应速率与计量数的比值大小判断,也可以将不同物质转化为同一种物质判断,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案
相关题目
9.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
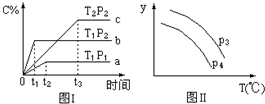

| A. | P3>P4,y轴表示B的转化率 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3<P4,y轴表示混合气体的平均摩尔质量 |
10.若取等质量的铝粉分别与足量的稀盐酸和NaOH溶液反应,所得氢气的体积在同样条件下相比( )
| A. | 与酸反应产生氢气多 | B. | 与碱反应产生氢气多 | ||
| C. | 一样多 | D. | 不知道铝粉的质量,无法比较 |
7.氨对地球上的生物相当重要,它是许多食物和肥料的重要成分.氨也是制造硝酸、化肥、炸药 的重要原料.氨在国民经济中占有重要地位.回答下列问题:
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充人2mol N2和6molH2,达平衡后放出的热量为Q2 kJ,则Q2>(填“>”、“<”或“=”)2Q1.
③已知:

1mol N-H键断裂吸收的能量约等于391kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2 (g)+3H2(g)?2NH3 (g),其平衡常数K与温度T的关系如表:
①平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,K1>(填“>”、“<”或“一”)K2.
②一定温度下,下列各项能作为判断该反应达到化学平衡状态的依据是bc(填字母).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.浓度商Q=平衡常数K
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应处于(填“处于”或“不处于”)平衡状态.
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充人2mol N2和6molH2,达平衡后放出的热量为Q2 kJ,则Q2>(填“>”、“<”或“=”)2Q1.
③已知:

1mol N-H键断裂吸收的能量约等于391kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2 (g)+3H2(g)?2NH3 (g),其平衡常数K与温度T的关系如表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②一定温度下,下列各项能作为判断该反应达到化学平衡状态的依据是bc(填字母).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.浓度商Q=平衡常数K
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应处于(填“处于”或“不处于”)平衡状态.
4.在一密闭容器中有如下反应:mA(g)+nB(g)?pC(g)△H.某化学兴趣小组根据此反应在不同条件下的实验数据,作出了如图曲线图:
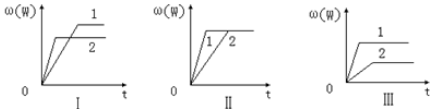
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
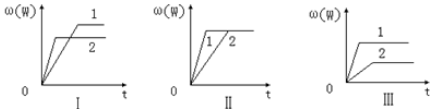
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
2.已知常温下:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述正确的是( )
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |