题目内容
14.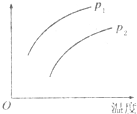 在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)?2C(g);△H>0(表示吸热).平衡移动关系如图所示,下列说法正确的是( )| A. | P1>P2,纵坐标指C的质量分数 | |
| B. | P1<P2,纵坐标指A的质量分数 | |
| C. | P1<P2.纵坐标指A的转化率 | |
| D. | P1<P2,纵坐标指混合气体的平均摩尔质量 |
分析 A(g)+2B(g)?2C(g)△H>0,为气体体积减小且放热的可逆反应,压强增大平衡正向移动,由图象可知,相同温度时,P1对应的Y大,相同压强时,温度越高对应的Y大,以此来解答.
解答 解:A(g)+2B(g)?2C(g)△H>0,为气体体积减小且放热的可逆反应,压强增大平衡正向移动,
A.P1>P2,压强增大平衡正向移动,C的质量分数增大,温度升高平衡正向移动,C的质量分数增大,则与图象符合,故A正确;
B.P1<P2,压强增大平衡正向移动,A的质量分数减小,温度升高平衡正向移动,A的质量分数减小则与图象不符合,故B错误;
C.P1<P2,压强增大平衡正向移动,A的转化率增大,则纵坐标不能为A的转化率,故C错误;
D.由反应可知反应前后气体的总质量不变,P1<P2,压强增大平衡正向移动,总物质的量减小,则混合气体的平均摩尔质量增大,与图象不符,故D错误;
故选A.
点评 本题考查化学平衡移动与图象,为高频考点,把握可逆反应的特点及压强对化学平衡的影响是解答本题的关键,注意图象中坐标及曲线的意义,选项B为易错点,题目难度中等.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
5.一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?xC(g)△H<0,B、C的物质的量随时间变化的关系如图一,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图二.
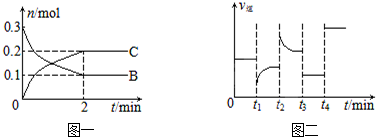
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大 | |
| B. | t1时改变的条件是降温,平衡逆向移动 | |
| C. | t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变 | |
| D. | x=2,反应开始2 min内,v(B)=0.1 mol/(L•min) |
9.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( )
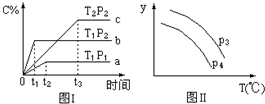

| A. | P3>P4,y轴表示B的转化率 | |
| B. | P3<P4,y轴表示B的体积分数 | |
| C. | P3<P4,y轴表示混合气体的密度 | |
| D. | P3<P4,y轴表示混合气体的平均摩尔质量 |
6.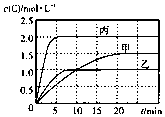 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
| A. | 若平衡时温度不变,改变容器体积平衡不移动 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | l0min内甲容器中反应的平均速率v(A)=0.025mol•(L•min)-1 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25% |
3.用标准浓度的盐酸来滴定锥形瓶中放置时间较长的氢氧化钠溶液,应选用的指示剂及滴定终点颜色变化的情况最好是( )
| A. | 石蕊,由蓝变红 | B. | 酚酞,红色褪去 | C. | 甲基橙,由黄变橙 | D. | 甲基橙,由橙变黄 |
4.在一密闭容器中有如下反应:mA(g)+nB(g)?pC(g)△H.某化学兴趣小组根据此反应在不同条件下的实验数据,作出了如图曲线图:
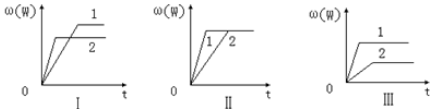
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
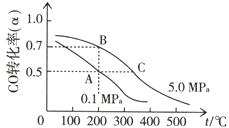 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.