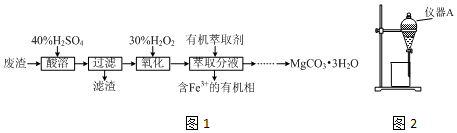
题目内容
9.煤和煤制品(如水煤气、焦炭、甲醚等)已广泛应用于工农业生产中.(1)已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3kJ.mol-l
CO2(g)+H2(g)=CO(g)+H2O(g)△H=+41.3kJ.mol-l
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90.0kJ.mol-1,该反应在高温(填“高温”、“低温”或“任何温度”)下有利于正向自发进行.
(2)利用炭还原法可处理氮氧化物(如NO等),发生的反应为C(s)+2NO(g)?N2(g)+CO2 (g).向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得的各气体的浓度如表所示:
| 时间(min) 浓度(mol•L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是AD(填字母).
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.遁当缩小容器的体积
(3)研究表明,反应CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)根据盖斯定律来写出碳与水蒸气反应生成一氧化碳和氢气的热化学方程式;根据反应能否自发进行的判据来回答;
(2)反应前后是气体体积不变的反应,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大,说明改变的条件是缩小体积增大浓度,或加入一氧化氮达到新平衡后个物质浓度增大;
(3)到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算.
解答 解:(1)已知①C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.3kJ•mol-1
根据盖斯定律,将①-②可得:C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90kJ•mol-1,反应的焓变△H>0,△S>0,根据反应自发进行的判据
△H-TS<0,所以需要高温下发生,
故答案为:C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+90.0 kJ•mol-1;高温;
(2)①10~20min内,N2的平均反应速率v(N2)=$\frac{0.25-0.16}{20-10}$mol/(L•min)=0.009 mol/(L•min),
故答案为:0.009 mol/(L•min);
②30min后,只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大;
A.通入一定量的NO,反应正向进行,达到平衡后一氧化氮、氮气、二氧化碳浓度增大,故符合;
B.加入一定量的活性炭是固体,对平衡无影响,故不符合;
C.加入合适的催化剂,只能改变化学反应速率,不能改变平衡,浓度不变,故不符合;
D.适当缩小容器的体积,反应前后是气体体积不变的反应,平衡不动,但个物质浓度增大,符合要求,故符合;
故答案为:AD;
(3)设CO的浓度变化量为c,三段式法用c表示出平衡时各组分个浓度,
CO(g)+H2O(g)?H2(g)+CO2(g),
起始(mol/L):0.02 0.020 0 0
转化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
代入500℃时反应平衡常数有k=$\frac{c({H}_{2})c(C{O}_{2})}{c(CO)c({H}_{2}O)}$=$\frac{{c}^{2}}{(0.02-c)^{2}}$=9,解得c=0.015,
CO的最大所以转化率为$\frac{0.015}{0.02}$×100%=75%,
故答案为:75%.
点评 本题综合性较大,涉及化学反应自发性判断、化学平衡常数、化学平衡影响因素、等效平衡计算等,题目难度中等.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案| A. | 通入22.4LSO2参加反应时,有2 NA个电子发生转移 | |
| B. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 | |
| C. | 滴加KI溶液时,KI被氧化,CuI是氧化产物 | |
| D. | 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | NH3通入A1C13溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
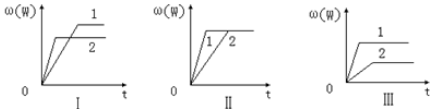
其中,ω表示C在反应混合物中的质量分数,t表示反应时间.其它条件不变时,下列分析正确的是( )
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,m+n<p | |
| B. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,m+n=p | |
| C. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,△H<0 | |
| D. | 若m+n<p,△H>0,则该反应在低温下容易自发进行 |
| A. | 常温常压下,48 g O3中的氧原子数为3NA | |
| B. | 24 g金属镁变为镁离子时失去的电子数为NA | |
| C. | 4℃时9 mL水和标准状况下11.2 L氮气中的原子数均为NA | |
| D. | 2 mol•L-l的CuCl2溶液中含有的氯离子数为4NA |
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.00 | 2.92 | 5.47 | 55.0 |
②25℃条件下,pH=4的盐酸溶液中由水电离出来的H+的浓度为1.0×10-10mol/L
③10℃时纯水的电离平衡常数为5.3×10-17.

| A. | 0~6 min内,反应的平均速率v(Cl2)=0.15 mol•L-1•min -1 | |
| B. | 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动 | |
| C. | 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)>T(15) | |
| D. | 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同 |
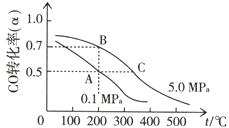 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.