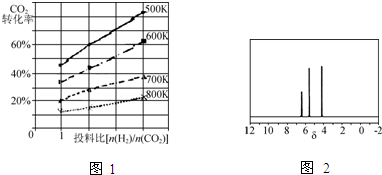
��Ŀ����
������ͭ[Cu��ClO4��2?6H2O]������ˮ��120�濪ʼ�ֽ⣬�����������缫���������ȣ������Ȼ�ͭͨ�����з�Ӧ�Ʊ���2CuCl2+2Na2CO3+H2O�TCu2��OH��2CO3��+CO2��+4NaCl��Cu2��OH��2CO3+4HClO4+9H2O�T2Cu��ClO4��2?6H2O+CO2����HClO4���ӷ��ķ���Һ�壬�¶ȸ���130���ױ�ը���±��г���Ӧ�������������������������pH����ʼ������pH����������Ũ��Ϊ1mol?L-1����
��1����CuCl2��Na2CO3���в��ֱ���ϸ�����������ķ�ˮ�����裬���ȳ�����ɫ��Һ�����á���ȴ�����ˡ�ϴ�ӵ���ɫCu2��OH��2CO3������
�ٰѷ�Ӧ����ϸ��Ŀ���� ��
�ڼ�������Ƿ�ϴ�Ӹɾ���Ӧѡ���Լ��� ��
��2����Cu2��OH��2CO3�����еμ��Թ�����HClO4С�Ľ��裬�ʶȼ��Ⱥ�õ���ɫCu��ClO4��2��Һͬʱ����������İ�����
�ٴ����İ����ijɷ��� ���ѧʽ����
���ʶȼ��ȵ��¶Ȳ��ܹ��ߵ�ԭ���� ��
��3��25��ʱ����������ҺpH=3������Һ�е�Fe3+�����ʵ���Ũ��Ϊ ������֪25��ʱ��Fe��OH��3��Ksp=2.64��10-39��
��4��ij�о�С�����ô�CuCl2���壨��Fe2+���Ʊ���������ˮ�Ȼ�ͭ���壮�벹�������ɴ�CuCl2�����Ʊ���������ˮ�Ȼ�ͭ�����ʵ�鲽�裨��ѡ�õ��Լ�������ˮ��ϡ���ᡢ˫��ˮ��Һ�Ͱ�ˮ�����ٽ���CuCl2������������ˮ������������ϡ����� �����ˣ��۽���Һ ���õ�CuCl2?2H2O���壻�ܽ� ���õ���ˮ�Ȼ�ͭ���壮
| �������� | ��ʼ���� | ������ȫ |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
�ٰѷ�Ӧ����ϸ��Ŀ����
�ڼ�������Ƿ�ϴ�Ӹɾ���Ӧѡ���Լ���
��2����Cu2��OH��2CO3�����еμ��Թ�����HClO4С�Ľ��裬�ʶȼ��Ⱥ�õ���ɫCu��ClO4��2��Һͬʱ����������İ�����
�ٴ����İ����ijɷ���
���ʶȼ��ȵ��¶Ȳ��ܹ��ߵ�ԭ����
��3��25��ʱ����������ҺpH=3������Һ�е�Fe3+�����ʵ���Ũ��Ϊ
��4��ij�о�С�����ô�CuCl2���壨��Fe2+���Ʊ���������ˮ�Ȼ�ͭ���壮�벹�������ɴ�CuCl2�����Ʊ���������ˮ�Ȼ�ͭ�����ʵ�鲽�裨��ѡ�õ��Լ�������ˮ��ϡ���ᡢ˫��ˮ��Һ�Ͱ�ˮ�����ٽ���CuCl2������������ˮ������������ϡ�����
���㣺����ʵ�鷽�������,�Ʊ�ʵ�鷽�������
ר�⣺ʵ�������
��������1���ٸ���Ӱ�췴Ӧ���ʵ����ط�����
�ڸ��ݷ�Ӧ2CuCl2+2Na2CO3+H2O�TCu2��OH��2CO3��+CO2��+4NaCl��֪�������������մ���Ȼ��ƣ��ʼ�������Ƿ�ϴ�Ӹɾ����ɼ��������ӵĴ��ڣ�Ӧѡ���Լ��� HNO3��AgNO3��Һ��
��2���ٸ���HClO4���ӷ��ķ���Һ�壬����֪�����İ����ijɷ���HClO4��
�ڸ��ݸ�����ͭ[Cu��ClO4��2?6H2O]120�濪ʼ�ֽ⣬HClO4���ӷ����¶ȸ���130���ױ�ը����֪���ʶȼ��ȵ��¶Ȳ��ܹ��ߣ�
��3������25��ʱ��ҺpH=3���ɵ�C��H+��=1.0��10-3mol/L��C��OH-��=
=
mol/L=1.0��10-11mol/L�����������������ܶȻ�Ksp[Fe��OH��3]=2.64��10-39����֪C��Fe3+����
��4���ڼ�������˫��ˮ��Һ����ֻ�ϣ�����������ת��Ϊ�����ӣ��ټ���������ˮ������ҺpH��3.2��4.7��ʹ��������ȫ��������ͭ���Ӳ����������ˣ��۽���Һ����Ũ������ȴ�ᾧ�����ˡ�����ˮ��ϴ�ӣ�����õ�CuCl2?2H2O���壻��Ϊ��ֹ����ʱͭ����ˮ�⣬�� CuCl2?2H2O������HCl�����м������������ٱ仯Ϊֹ���õ���ˮ�Ȼ�ͭ���壮
�ڸ��ݷ�Ӧ2CuCl2+2Na2CO3+H2O�TCu2��OH��2CO3��+CO2��+4NaCl��֪�������������մ���Ȼ��ƣ��ʼ�������Ƿ�ϴ�Ӹɾ����ɼ��������ӵĴ��ڣ�Ӧѡ���Լ��� HNO3��AgNO3��Һ��
��2���ٸ���HClO4���ӷ��ķ���Һ�壬����֪�����İ����ijɷ���HClO4��
�ڸ��ݸ�����ͭ[Cu��ClO4��2?6H2O]120�濪ʼ�ֽ⣬HClO4���ӷ����¶ȸ���130���ױ�ը����֪���ʶȼ��ȵ��¶Ȳ��ܹ��ߣ�
��3������25��ʱ��ҺpH=3���ɵ�C��H+��=1.0��10-3mol/L��C��OH-��=
| kw |
| c(H+) |
| 1��10-14 |
| 10-3 |
��4���ڼ�������˫��ˮ��Һ����ֻ�ϣ�����������ת��Ϊ�����ӣ��ټ���������ˮ������ҺpH��3.2��4.7��ʹ��������ȫ��������ͭ���Ӳ����������ˣ��۽���Һ����Ũ������ȴ�ᾧ�����ˡ�����ˮ��ϴ�ӣ�����õ�CuCl2?2H2O���壻��Ϊ��ֹ����ʱͭ����ˮ�⣬�� CuCl2?2H2O������HCl�����м������������ٱ仯Ϊֹ���õ���ˮ�Ȼ�ͭ���壮
���
�⣺��1���ٰѷ�Ӧ����ϸ��Ŀ���� ����Ӧ��֮��ĽӴ������ʹ��Ӧ�������ʴ�Ϊ������Ӧ��֮��ĽӴ������ʹ��Ӧ��������
�ڸ��ݷ�Ӧ2CuCl2+2Na2CO3+H2O�TCu2��OH��2CO3��+CO2��+4NaCl��֪�������������մ���Ȼ��ƣ��ʼ�������Ƿ�ϴ�Ӹɾ����ɼ��������ӵĴ��ڣ�Ӧѡ���Լ��� HNO3��AgNO3��Һ���ʴ�Ϊ��HNO3��AgNO3��Һ��
��2���ٸ���HClO4���ӷ��ķ���Һ�壬����֪�����İ����ijɷ���HClO4���ʴ�Ϊ��HClO4��
�ڸ��ݸ�����ͭ[Cu��ClO4��2?6H2O]120�濪ʼ�ֽ⣬HClO4���ӷ����¶ȸ���130���ױ�ը����֪���ʶȼ��ȵ��¶Ȳ��ܹ��ߣ��ʴ�Ϊ����ֹHClO4��Cu��ClO4��2�ֽ⣻
��3��25��ʱ����������ҺpH=3��C��H+��=1.0��10-3mol/L��C��OH-��=
mol/L=1.0��10-11mol/L�����������������ܶȻ�Ksp[Fe��OH��3]=2.64��10-39����֪C��Fe3+��=
mol/L=2.64��10-6 mol?L-1���ʴ�Ϊ��2.64��10-6 mol?L-1��
��4��ij�о�С�����ô�CuCl2���壨��Fe2+���Ʊ���������ˮ�Ȼ�ͭ���壮ʵ�鲽�裨��ѡ�õ��Լ�������ˮ��ϡ���ᡢ˫��ˮ��Һ�Ͱ�ˮ�����ٽ���CuCl2������������ˮ������������ϡ����ڼ�������˫��ˮ��Һ����ֻ�ϣ�����������ת��Ϊ�����ӣ��ټ���������ˮ������ҺpH��3.2��4.7��ʹ��������ȫ��������ͭ���Ӳ����������ˣ��۽���Һ����Ũ������ȴ�ᾧ�����ˡ�����ˮ��ϴ�ӣ�����õ�CuCl2?2H2O���壻��Ϊ��ֹ����ʱͭ����ˮ�⣬�� CuCl2?2H2O������HCl�����м������������ٱ仯Ϊֹ���õ���ˮ�Ȼ�ͭ���壬
�ʴ�Ϊ���ڼ�������˫��ˮ��Һ����ֻ�ϣ��ټ���������ˮ������ҺpH��3.2��4.7���۽���Һ����Ũ������ȴ�ᾧ�����ˡ�����ˮ��ϴ�ӣ�����ܽ� CuCl2?2H2O������HCl�����м������������ٱ仯Ϊֹ��
�ڸ��ݷ�Ӧ2CuCl2+2Na2CO3+H2O�TCu2��OH��2CO3��+CO2��+4NaCl��֪�������������մ���Ȼ��ƣ��ʼ�������Ƿ�ϴ�Ӹɾ����ɼ��������ӵĴ��ڣ�Ӧѡ���Լ��� HNO3��AgNO3��Һ���ʴ�Ϊ��HNO3��AgNO3��Һ��
��2���ٸ���HClO4���ӷ��ķ���Һ�壬����֪�����İ����ijɷ���HClO4���ʴ�Ϊ��HClO4��
�ڸ��ݸ�����ͭ[Cu��ClO4��2?6H2O]120�濪ʼ�ֽ⣬HClO4���ӷ����¶ȸ���130���ױ�ը����֪���ʶȼ��ȵ��¶Ȳ��ܹ��ߣ��ʴ�Ϊ����ֹHClO4��Cu��ClO4��2�ֽ⣻
��3��25��ʱ����������ҺpH=3��C��H+��=1.0��10-3mol/L��C��OH-��=
| 1��10-14 |
| 10-3 |
| 2.64��10-39 |
| (10-11)3 |
��4��ij�о�С�����ô�CuCl2���壨��Fe2+���Ʊ���������ˮ�Ȼ�ͭ���壮ʵ�鲽�裨��ѡ�õ��Լ�������ˮ��ϡ���ᡢ˫��ˮ��Һ�Ͱ�ˮ�����ٽ���CuCl2������������ˮ������������ϡ����ڼ�������˫��ˮ��Һ����ֻ�ϣ�����������ת��Ϊ�����ӣ��ټ���������ˮ������ҺpH��3.2��4.7��ʹ��������ȫ��������ͭ���Ӳ����������ˣ��۽���Һ����Ũ������ȴ�ᾧ�����ˡ�����ˮ��ϴ�ӣ�����õ�CuCl2?2H2O���壻��Ϊ��ֹ����ʱͭ����ˮ�⣬�� CuCl2?2H2O������HCl�����м������������ٱ仯Ϊֹ���õ���ˮ�Ȼ�ͭ���壬
�ʴ�Ϊ���ڼ�������˫��ˮ��Һ����ֻ�ϣ��ټ���������ˮ������ҺpH��3.2��4.7���۽���Һ����Ũ������ȴ�ᾧ�����ˡ�����ˮ��ϴ�ӣ�����ܽ� CuCl2?2H2O������HCl�����м������������ٱ仯Ϊֹ��
���������⿼���������Ʊ�ʵ����Ʋ�����̷����жϣ��й�Ksp���㣬���ʷ����ᴿ��ʵ�鷽��Ӧ�õȣ���Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
 �������������������֣���ͼ�����е�һ�ַ�����������ȷ���ǣ�������
�������������������֣���ͼ�����е�һ�ַ�����������ȷ���ǣ�������| A����ͼ��ʾ���������������������� |
| B����բ����������������ԭ��Ӧ |
| C����������a����բ�ţ������缫��b |
| D�������缫�ϵķ�Ӧ��O2+2H2O+4e=4OH- |
��������ĵ���ƽ�ⳣ�����±���
����ѡ����ȷ���ǣ�������
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� ��25�棩 |
Ka=1.77��10-4 | Ka=4.9��10-10 | Ka1=4.3��10-7 Ka2=5.6��10-11 |
| A��2CN-+H2O+CO2�T2HCN+CO32- |
| B���к͵��������pH��HCOOH��HCN����NaOH����ǰ��С�ں��� |
| C�����ʵ���Ũ����ȵ�HCOONa��KCN��Һ�У�c��Na+��-c��HCOO-����c��K+��-c��CN-�� |
| D��c��NH4+����ȵ�HCOONH4��Һ��NH4CN��Һ��NH4HCO3��Һ�У�c��NH4HCO3����c��NH4CN����c��HCOONH4�� |
���з�Ӧ�����ӷ���ʽ��д��ȷ���ǣ�������
| A����ʳ�׳�ȥˮ���ڵ�ˮ����CaCO3+2H+�TCa2++CO2��+H2O |
| B����FeCl3��Һ��ʴͭ��·�壺Cu+Fe3+�TCu2++Fe2+ |
| C��FeBr2��Һ��ͨ������Cl2��2Br-+Cl2�TBr2+2Cl- |
| D����NaHCO3��Һ�м�������ʯ��ˮ��2HCO3-+2OH-+Ca2+�TCaCO3��+CO32-+2H2O |
����ʵ��װ���ܴﵽʵ��Ŀ���ǣ�������
A��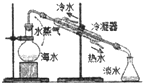 ��ˮ���� |
B��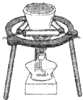 ���ڿ����е�ȼ�� |
C��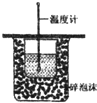 �ⶨ�к��� |
D�� �������������������� |
 ��������ѧ֪ʶ������������⣺
��������ѧ֪ʶ������������⣺