题目内容
加大对煤燃烧产生的废气、废渣的处理已刻不容缓.
(1)对燃煤的废气进行脱硝处理时,可利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=a kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=b kJ?mol-1
则反应CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)的△H= kJ?mol-1(用含a、b的代数式表示).
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g);△H
①该反应平衡常数表达式为K= .
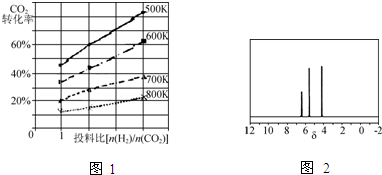
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图1所示.该反应的△H (填“>”“<”或“=”)0.若温度不变,减小反应投料比[
],则K将 (填“增大”“减小”或“不变”).
③二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为 .
(3)以CO2为原料合成的碳酸酯(仅含碳、氢、氧三种元素)是用途广泛的化学品,某种碳酸酯(DPC)水解产物之一遇氯化铁溶液显紫色,图2为它的核磁共振氢谱图,请写出DPC的结构简式: .
(4)某电厂的粉煤灰含莫来石(主要成分为Al6Si2O13、SiO2).将其和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式(反应条件均为高温)为:
Al6Si2O13+3Na2CO3═2NaAlSiO4+4NaAlO2+3CO2↑
Al6Si2O13+5Na2CO3═2Na2SiO3+6NaAlO2+5CO2↑
SiO2+Na2CO3═Na2SiO3+CO2↑
则用1mol Al6Si2O13和4mol SiO2通过以上反应制得5mol NaAlO2,共消耗Na2CO3为 mol.
(1)对燃煤的废气进行脱硝处理时,可利用甲烷催化还原氮氧化物,如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=a kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=b kJ?mol-1
则反应CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)的△H=
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)
| ||
①该反应平衡常数表达式为K=
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图1所示.该反应的△H
| n(H2) |
| n(CO2) |

③二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为
(3)以CO2为原料合成的碳酸酯(仅含碳、氢、氧三种元素)是用途广泛的化学品,某种碳酸酯(DPC)水解产物之一遇氯化铁溶液显紫色,图2为它的核磁共振氢谱图,请写出DPC的结构简式:
(4)某电厂的粉煤灰含莫来石(主要成分为Al6Si2O13、SiO2).将其和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式(反应条件均为高温)为:
Al6Si2O13+3Na2CO3═2NaAlSiO4+4NaAlO2+3CO2↑
Al6Si2O13+5Na2CO3═2Na2SiO3+6NaAlO2+5CO2↑
SiO2+Na2CO3═Na2SiO3+CO2↑
则用1mol Al6Si2O13和4mol SiO2通过以上反应制得5mol NaAlO2,共消耗Na2CO3为
考点:化学平衡常数的含义,反应热和焓变,化学电源新型电池,化学平衡建立的过程
专题:基本概念与基本理论
分析:(1)根据盖斯定律,利用已知化学反应方程式乘以某个系数相加或相减,构造出目标化学反应方程式,该化学反应的焓变即为已知化学反应方程式的焓变乘以某个系数相加或相减得到;
(2)①平衡常数表达式是生成物浓度幂之积比上反应物浓度幂之积,固体和纯液体不代入表达式;
②根据温度对平衡的影响分析△H的符号;平衡常数K只与温度有关;
③甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,依据电极书写方法写出电极反应;
(3)以CO2为原料合成的碳酸酯,这种碳酸酯(DPC)水解产物之一遇氯化铁溶液显紫色说明生成酚类物质,图2为它的核磁共振氢谱图有三种峰,可知水解产生苯酚,而且酯的结构是对称的;
(4)根据物质的用量和参加反应的物质来书写化学方程式.
(2)①平衡常数表达式是生成物浓度幂之积比上反应物浓度幂之积,固体和纯液体不代入表达式;
②根据温度对平衡的影响分析△H的符号;平衡常数K只与温度有关;
③甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,依据电极书写方法写出电极反应;
(3)以CO2为原料合成的碳酸酯,这种碳酸酯(DPC)水解产物之一遇氯化铁溶液显紫色说明生成酚类物质,图2为它的核磁共振氢谱图有三种峰,可知水解产生苯酚,而且酯的结构是对称的;
(4)根据物质的用量和参加反应的物质来书写化学方程式.
解答:
解:(1)因盖斯定律,不管化学反应是一步完成还是分几步完成,其反应热是相同的.两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=(a+b)kJ/mol
即:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=
kJ/mol 故答案为:
;
(2)①平衡常数表达式是生成物浓度幂之积比上反应物浓度幂之积,固体和纯液体不代入表达式,所以K=
,故答案为:
;
②因为温度越高,CO2转化率越小,则平衡逆移,所以该反应正方向为放热反应,即△H<0,K只受温度影响,若温度不变,减小投料比,则K不变,故答案为:<;不变;
③甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,电极反应式为:CH3OCH3-12e-+3H2O═2CO2+12H+,故答案为:CH3OCH3-12e-+3H2O═2CO2+12H+;
(3)以CO2为原料合成的碳酸酯,这种碳酸酯(DPC)水解产物之一遇氯化铁溶液显紫色说明生成酚类物质,图2为它的核磁共振氢谱图有三种峰,可知水解产生苯酚,而且酯的结构是对称的,这种酯为酚酯,故答案为: ;
;
(4)用1mol Al6Si2O13和 4mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,可以得出反应的方程式为:4SiO2+Al6Si2O13+8Na2CO3=5Na2SiO3+5NaAlO2+8CO2↑+NaAlSiO4,故答案为:8.
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=(a+b)kJ/mol
即:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=
| a+b |
| 2 |
| a+b |
| 2 |
(2)①平衡常数表达式是生成物浓度幂之积比上反应物浓度幂之积,固体和纯液体不代入表达式,所以K=
| c(CH3OCH3)×c3(H2O) |
| c2(CO2)×c6(H2) |
| c(CH3OCH3)×c3(H2O) |
| c2(CO2)×c6(H2) |
②因为温度越高,CO2转化率越小,则平衡逆移,所以该反应正方向为放热反应,即△H<0,K只受温度影响,若温度不变,减小投料比,则K不变,故答案为:<;不变;
③甲醚作为燃料电池的原料.甲醚在负极失电子发生氧化反应,电极反应式为:CH3OCH3-12e-+3H2O═2CO2+12H+,故答案为:CH3OCH3-12e-+3H2O═2CO2+12H+;
(3)以CO2为原料合成的碳酸酯,这种碳酸酯(DPC)水解产物之一遇氯化铁溶液显紫色说明生成酚类物质,图2为它的核磁共振氢谱图有三种峰,可知水解产生苯酚,而且酯的结构是对称的,这种酯为酚酯,故答案为:
 ;
; (4)用1mol Al6Si2O13和 4mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,可以得出反应的方程式为:4SiO2+Al6Si2O13+8Na2CO3=5Na2SiO3+5NaAlO2+8CO2↑+NaAlSiO4,故答案为:8.
点评:本题考查了盖斯定律的应用及热化学方程式的书写、影响平衡移动及平衡常数的因素、化学平衡的有关计算、原电池原理;侧重于反应原理的应用的考查,题目难度中等,注意燃料电池中电解质溶液的酸碱性对电极反应的影响,以及化合物知识的相关计算题.

练习册系列答案
相关题目
有一种电池由甲醇、氯气以及强碱等电解质溶液组成,其容量达氢电池或锂电池的十几倍.其电池反应为:
2CH3OH+3O2+4OH-
2CO32-+6H2O,则下列说法不正确的是( )
2CH3OH+3O2+4OH-
| ||
| 充电 |
| A、放电时,CH3OH参与反应的电极是负极,发生了还原反应 |
| B、充电时,电解质溶液的PH逐渐增大 |
| C、放电时,负极的电极反应离子方程式:CH3OH+8OH--6e-═CO32-+6H2O |
| D、用该电池电解CuCl2溶液,产生3.36L Cl2(标准状况)时,消耗甲醇为1.6g |
下列有关电解质溶液的说法正确的是( )
| A、蒸馏水中逐渐加入NaOH(s)的过程中KW不变 |
| B、CaCO3难溶于稀硫酸,更难溶于醋酸 |
| C、在Na2CO3稀溶液中,c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-) |
| D、NaCl溶液和BaCl2溶液中水的KW不同 |
t℃时,将100g某物质A的溶液蒸发掉10g水,恢复至t℃,析出2.5g晶体;再蒸发掉10g水,恢复至t℃,析出7.5g晶体.下列说法中正确的是( )
| A、t℃时原溶液是饱和溶液 |
| B、t℃时A的溶解度为75g |
| C、若A是CuSO4,则7.5g晶体中含水2.7g |
| D、原溶液中A的质量分数为40% |
下列有关化学用语表示正确的是( )
A、甲烷分子球棍模型: |
| B、二氧化硅的分子式:SiO2 |
C、S2-离子结构示意图 |
D、聚丙烯的结构简式: |
 煤的干馏实验如图所示:
煤的干馏实验如图所示: