题目内容
下列实验装置能达到实验目的是( )
A、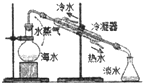 海水蒸馏 |
B、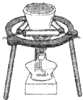 钾在空气中的燃烧 |
C、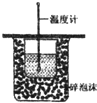 测定中和热 |
D、 牺牲阳极的阴极保护法 |
考点:化学实验方案的评价,金属的电化学腐蚀与防护,实验室制取蒸馏水,中和热的测定,碱金属及其化合物的性质实验
专题:实验评价题
分析:A.冷水应从下口进入;
B.在坩埚中可完成K的燃烧反应;
C.缺少环形玻璃搅拌棒;
D.由外加电源可知,Zn为阳极,Fe为阴极,Fe被保护.
B.在坩埚中可完成K的燃烧反应;
C.缺少环形玻璃搅拌棒;
D.由外加电源可知,Zn为阳极,Fe为阴极,Fe被保护.
解答:
解:A.图中蒸馏装置,冷水应从下口进入,冷却效果好,而图中下口流出热水,则操作不合理,故A错误;
B.在坩埚中可完成K的燃烧反应,图中实验操作合理,故B正确;
C.缺少环形玻璃搅拌棒,不能测定反应的最高温度,则不能测定中和热,故C错误;
D.由外加电源可知,Zn为阳极,Fe为阴极,Fe被保护,则该方法为外加电源的阴极保护法,故D错误;
故选B.
B.在坩埚中可完成K的燃烧反应,图中实验操作合理,故B正确;
C.缺少环形玻璃搅拌棒,不能测定反应的最高温度,则不能测定中和热,故C错误;
D.由外加电源可知,Zn为阳极,Fe为阴极,Fe被保护,则该方法为外加电源的阴极保护法,故D错误;
故选B.
点评:本题考查化学实验方案的评价,为高频考点,把握蒸馏实验、中和热测定实验及电化学腐蚀及防护、燃烧实验等知识点即可解答,注意实验装置图的评价性、操作性分析,侧重物质性质及实验技能的考查,题目难度不大.

练习册系列答案
相关题目
 为了保持注水肉的色泽和水分,不法商赈向猪体内加入含有沙丁胺醇(如图)的胶类物质,该物质对人体危害很大,关于该物质以下说法不正确的是( )
为了保持注水肉的色泽和水分,不法商赈向猪体内加入含有沙丁胺醇(如图)的胶类物质,该物质对人体危害很大,关于该物质以下说法不正确的是( )| A、该物质属于芳香族化台物 |
| B、在一定条件下可发生取代反应和加成反应 |
| C、1mol该有机物与足量钠反应生成3NA个H2分子 |
| D、该有机物的分子式为C3H21NO3 |
下列解释实验过程或事实的反应方程式不正确的是( )
A、熔融烧碱时,不能使用氧化铝坩埚:Al2O3+2NaOH
| ||||
| B、刻制印刷电路时用FeCl3溶液作为“腐蚀液”:2Fe3++Cu=Cu2++2Fe2+ | ||||
C、打磨后的镁条置于沸水中,滴加酚酞溶液变红色:Mg+2H2O(g)
| ||||
| D、向KI溶液中滴加硫酸酸化的双氧水,溶液呈棕黄色:2I-+H2O2+2H+=I2+O2↑+2H2O |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、0.1mol?L-1 Na2S溶液中含有的Na+离子数为0.2NA |
| B、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| C、标准状况下,22.4L以任意比例混合的氢气和氯气混合气中含有的原子总数为2NA |
| D、0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
下列有关化学用语表示正确的是( )
A、甲烷分子球棍模型: |
| B、二氧化硅的分子式:SiO2 |
C、S2-离子结构示意图 |
D、聚丙烯的结构简式: |
下列有关说法正确的是( )
| A、标准状况下,33.6L HF中含有氟原子的数目为1.5NA |
| B、1L 0.1mol/L的碳酸钠溶液中的阴离子总数等于0.1NA |
| C、30g SiO2中有0.5NA个[SiO4]四面体 |
| D、某密闭容器中盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
XeF4在水中的反应为:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑.下列说法中正确的是( )
| A、XeF4分子中各原子均达到8电子稳定结构 |
| B、XeF4分子中Xe的化合价为0价 |
| C、上述反应中氧化剂和还原剂的物质的量之比为2:3 |
| D、XeF4按上述方式水解,每生成4mol Xe,转移16mol电子 |