题目内容
20.A、B、C、X、Y、Z是元素周期表中的前20号元素,且原子序数依次增大.已知它们的部分化合物的性质如下:| A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
| 含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
(1)写出对应元素的名称:A碳、B氮、C氟、X铝、Y硅、Z氯
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):Ca>Al>Si
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:
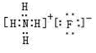 .
.(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:2F2+2H2O=4HF+O2.
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和“>“、“<“或“=“表示:)CO2<SiO2并说明理由CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合,共价键强度大于分子间作用力,故SiO2熔点比CO2的熔点高.
分析 A是含氢量最高的有机物,应为CH4,则A为H元素;B的最简氢化物水溶液呈碱性,应为NH3,则B为N元素;M的最简氢化物水溶液呈酸性,结合原子序数大小可知M为F元素;X的氧化物为两性氧化物,应为Al元素;Y的最简氢化物分子构型是正四面体,应为Si元素;Z价电子排布为4s2,则Z为Cl元素,结合对应的物质的性质以及题目要求解答该题.
解答 解:A是含氢量最高的有机物,应为CH4,则A为H元素;B的最简氢化物水溶液呈碱性,应为NH3,则B为N元素;M的最简氢化物水溶液呈酸性,结合原子序数大小可知M为F元素;X的氧化物为两性氧化物,应为Al元素;Y的最简氢化物分子构型是正四面体,应为Si元素;Z价电子排布为4s2,则Z为Cl元素,
(1)根据分析可知,A为碳、B为氮、C为氟、X为铝、Y为硅、Z为钙元素,
故答案为:碳;氮;氟;铝;硅;钙;
(2)X为Al、Y为Si、Z为Ca元素,电子层越多原子半径越大,电子层相同时核电荷数越大原子半径越小,则原子半径大小为:Ca>Al>Si,
故答案为:Ca>Al>Si;
(3)B的氢化物为氨气,C的氢化物为HF,二者反应后生成NH4F,NH4F为离子化合物,其电子式为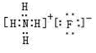 ,
,
故答案为: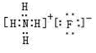 ;
;
(4)C的单质为F2,F2能在水中产生一种常见的氧化性单质,该单质为氧气,该反应的化学方程式为:2F2+2H2O=4HF+O2,
故答案为:2F2+2H2O=4HF+O2;
(5)A和Y的最高价氧化物分别为CO2、SiO2,CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合;共价键强度大于分子间力,则SiO2熔点较高,
故答案为:CO2<SiO2;CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合,共价键强度大于分子间作用力,故SiO2熔点比CO2的熔点高.
点评 本题考查原子结构与元素周期律的关系,侧重于物质的性质、晶体结构与性质、化学方程式书写等问题,综合考查学生的分析能力和基本理论、概念的综合运用,难度中等.

| A. | 该溶液的pH<7 | B. | CN-的水解程度大于HCN的电离程度 | ||
| C. | c(CN-)+c(HCN)=0.02 mol•L-1 | D. | c(CN-)+c(OH-)=0.01 mol•L-1+c(H+) |
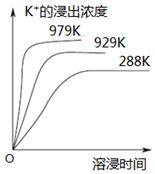 已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )
已知难溶性物质K2SO4•MgSO4•2CaSO4在水中存在如下平衡:K2SO4•MgSO4•2CaSO4 (s)?2Ca2++2K++Mg2++4SO42-.不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( )| A. | 该平衡的Ksp=c2(Ca2+)•c2(K+)•c(Mg2+)•c4(SO42-) | |
| B. | 向该体系中加入饱和K2SO4溶液,溶解平衡向左移动 | |
| C. | 升高温度,溶浸速率增大,平衡向正反应方向移动 | |
| D. | 向该体系中加入饱和NaOH溶液,溶解平衡不发生移动 |
| A. | 甲苯的一氯代物有三种同分异构体 | |
| B. | 乙醇能使高锰酸钾溶液褪色 | |
| C. | 乙烯、苯、乙酸分子中的所有原子都在同一个平面上 | |
| D. | C2H4O2和C4H8O2分子组成相差2个CH2,一定互为同系物 |
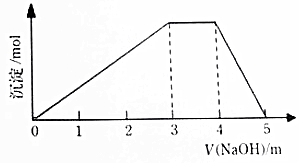 中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 由R、X、Y、M四种元素只组成一种盐 | |
| D. | 最高价氧化物对应水化物的酸性:M>Z |
| A. | 碳酸钙受热分解 | B. | 食物氧化腐败 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 酸与碱的中和反应 |
| A. | HCl→Cl2→HClO→NaClO | B. | Na→Na2O2→Na2CO3→NaHCO3 | ||
| C. | Al→NaAlO2→Al(OH)3→Al2O3 | D. | Si→SiO2→H2SiO3→Na2SiO3 |
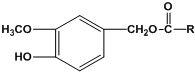 (R为烃基)
(R为烃基)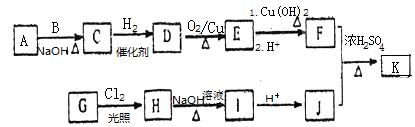
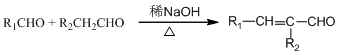
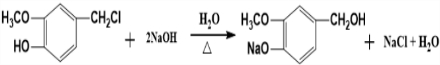 ,
,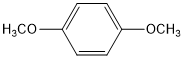 ,
,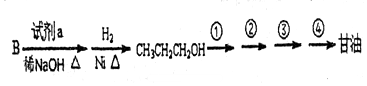

 B.
B. C.泡利原理 D.洪特规则
C.泡利原理 D.洪特规则