题目内容
15.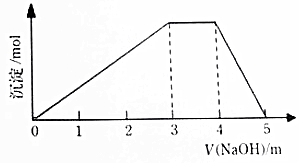 中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子最外层电子数是电子层数的3倍.这五中元素组成一种离子化合物Q.取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示,下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 由R、X、Y、M四种元素只组成一种盐 | |
| D. | 最高价氧化物对应水化物的酸性:M>Z |
分析 短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期,则R为H元素;Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍,Y应该位于第二周期,则Y为O元素、M为S元素;根据图象可知,生成沉淀为氢氧化铝,沉淀量不变时是铵根离子与氢氧根离子的反应,则Q中一定含有铝离子和铵根离子,应该为NH4Al(SO4)2,结合原子序数大小可知X为N、Z为Al元素,据此进行解答.
解答 解:短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期,则R为H元素;Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍,Y应该位于第二周期,则Y为O元素、M为S元素;根据图象可知,生成沉淀为氢氧化铝,沉淀量不变时是铵根离子与氢氧根离子的反应,则Q中一定含有铝离子和铵根离子,应该为NH4Al(SO4)2,结合原子序数大小可知X为N、Z为Al元素,
A.M、Y、Z分别为S、O、Al,硫离子含有3个电子层,其离子半径最大,氧离子和铝离子都含有2个电子层,氧元素的核电荷数较小,其离子半径较大,则简单的离子半径:M>Y>Z,故A正确;
B.X、Y分别为N、O元素,非金属性N<O,非金属性越强,对应氢化物稳定性越强,则气态氢化物的热稳定性:Y>X,故B正确;
C.D.R、X、Y、M分别为H、N、O、S元素,四种元素可以形成硫酸铵、亚硫酸铵等多种盐,故C错误;
D.M为S元素,Z为Al元素,二者对应最高价氧化物分别为硫酸、氢氧化铝,硫酸为强酸,氢氧化铝为两性氢氧化物,则最高价氧化物对应水化物的酸性:M>Z,故D正确;
故选C.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,根据图象曲线变化正确推断Q的组成为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系.

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案| A. | 分散质粒子的大小 | B. | 能否透过滤纸或半透膜 | ||
| C. | 是否为大量分子或离子的集合法 | D. | 能否产生丁达尔效应 |
| A. | 化合物X是烃类物质 | B. | 化合物X的实验式为CH4 | ||
| C. | 化合物X具有多种同分异构体 | D. | 可以确定化合物X的结构式 |
| A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
| 含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
(1)写出对应元素的名称:A碳、B氮、C氟、X铝、Y硅、Z氯
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):Ca>Al>Si
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:
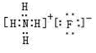 .
.(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:2F2+2H2O=4HF+O2.
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和“>“、“<“或“=“表示:)CO2<SiO2并说明理由CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合,共价键强度大于分子间作用力,故SiO2熔点比CO2的熔点高.
| A. | 42gC3H6中含有的共用电子对数目为8NA | |
| B. | 标准状况下,22.4L氯气与56g铁充分反应,转移的电子数为3NA | |
| C. | 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.1lNA | |
| D. | 1L0.01mol/LKAl(SO4)2溶液中含有的阳离子数为0.02NA |
| A. | 原混合溶液中 c(K+)为 2 mol•L-1 | |
| B. | 电解过程中共转移 8 mol电子 | |
| C. | 电解得到的Cu 的物质的量为 0.5 mol | |
| D. | 电解后溶液中的 c(H+)为 2 mol•L-1 |

 ,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl
,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl .
. 或
或 .
.