题目内容
12.下列反应中生成物总能量高于反应物总能量的是( )| A. | 碳酸钙受热分解 | B. | 食物氧化腐败 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 酸与碱的中和反应 |
分析 生成物总能量高于反应物总能量,该反应吸热,结合大多数的分解反应为吸热反应来解答.
解答 解:B、C、D均为放热反应,且生成物总能量低于反应物总能量,而A中碳酸钙分解为吸热反应,满足生成物总能量高于反应物总能量,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化为解答的关键,侧重分析与应用能力的考查,注意归纳常见的吸热反应,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
3.某化合物X 3.2g在氧气中完全燃烧,只生成4.4gCO2和3.6 H2O,下列说法正确的是( )
| A. | 化合物X是烃类物质 | B. | 化合物X的实验式为CH4 | ||
| C. | 化合物X具有多种同分异构体 | D. | 可以确定化合物X的结构式 |
20.A、B、C、X、Y、Z是元素周期表中的前20号元素,且原子序数依次增大.已知它们的部分化合物的性质如下:
回答下列问题:
(1)写出对应元素的名称:A碳、B氮、C氟、X铝、Y硅、Z氯
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):Ca>Al>Si
(3)写出B的氢化物与C的氢化物反应后生成物的电子式: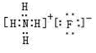 .
.
(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:2F2+2H2O=4HF+O2.
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和“>“、“<“或“=“表示:)CO2<SiO2并说明理由CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合,共价键强度大于分子间作用力,故SiO2熔点比CO2的熔点高.
| A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
| 含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
(1)写出对应元素的名称:A碳、B氮、C氟、X铝、Y硅、Z氯
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):Ca>Al>Si
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:
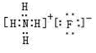 .
.(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:2F2+2H2O=4HF+O2.
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和“>“、“<“或“=“表示:)CO2<SiO2并说明理由CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合,共价键强度大于分子间作用力,故SiO2熔点比CO2的熔点高.
4.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 42gC3H6中含有的共用电子对数目为8NA | |
| B. | 标准状况下,22.4L氯气与56g铁充分反应,转移的电子数为3NA | |
| C. | 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.1lNA | |
| D. | 1L0.01mol/LKAl(SO4)2溶液中含有的阳离子数为0.02NA |
1.下列关于有机化合物的说法正确的是 ( )
| A. | 2-甲基丁烷的一溴代物有4种 | |
| B. | 乙烯和聚氯乙烯都能使溴水褪色 | |
| C. | 乙醇、乙酸既可用NaOH区分,也可以用小苏打区分 | |
| D. | 乙酸乙酯既能发生加成反应又能发生水解反应 |
17.下列说法一定不正确的是( )
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn ),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是 222 | |
| B. | Se 是人体必需的微量元素,${\;}_{34}^{78}$Se 和${\;}_{34}^{80}$Se 互为同位素 | |
| C. | ${\;}_{92}^{235}$U 的浓缩一直被国际社会关注,${\;}_{92}^{235}$U 与 ${\;}_{92}^{238}$U 是两种不同的核素 | |
| D. | ${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析,${\;}_{6}^{13}$C 的中子数为 6 |

 ,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl
,G→I一步反应的产物除了I、N(C2H5)3、还有NaCl .
. 或
或 .
.