题目内容
8.下列说法正确的是( )| A. | 甲苯的一氯代物有三种同分异构体 | |
| B. | 乙醇能使高锰酸钾溶液褪色 | |
| C. | 乙烯、苯、乙酸分子中的所有原子都在同一个平面上 | |
| D. | C2H4O2和C4H8O2分子组成相差2个CH2,一定互为同系物 |
分析 A.甲苯中苯环上有3种H,甲基上有1种H;
B.乙醇含-OH,能被强氧化剂氧化;
C.乙酸中含甲基,甲基为四面体结构;
D.C2H4O2和C4H8O2可能为羧酸或酯.
解答 解:A.甲苯中苯环上有3种H,甲基上有1种H,则甲苯的一氯代物有4种同分异构体,故A错误;
B.乙醇含-OH,能被强氧化剂氧化,则乙醇能使高锰酸钾溶液褪色,故B正确;
C.乙酸中含甲基,甲基为四面体结构,不可能所有原子共面,而乙烯、苯分子中的所有原子都在同一个平面上,故C错误;
D.C2H4O2和C4H8O2可能为羧酸或酯,若分别为乙酸、乙酸乙酯时,不是同系物,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应、有机物的结构为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
相关题目
18.在25℃时,pH等于3的H2SO4溶液和NH4Cl溶液中,水的电离程度大小比较正确的是( )
| A. | 相等 | B. | 前者比后者大3倍 | ||
| C. | 后者是前者的1011倍 | D. | 后者是前者的108倍 |
19.A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下,其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C与F可形成D和G分子.
(1)A粒子的结构示意图是 .
.
(2)用电子式表示D的形成过程:
(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为NaOH>Mg(OH)2(用化学式表示).
(4)D与G反应的化学方程式是NH3+H2O═NH3•H2O.
(5)C粒子是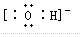 ,F粒子是
,F粒子是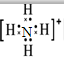 (用电子式表示).
(用电子式表示).
| 微粒 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
 .
.(2)用电子式表示D的形成过程:

(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为NaOH>Mg(OH)2(用化学式表示).
(4)D与G反应的化学方程式是NH3+H2O═NH3•H2O.
(5)C粒子是
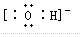 ,F粒子是
,F粒子是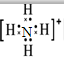 (用电子式表示).
(用电子式表示).
16.黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源.
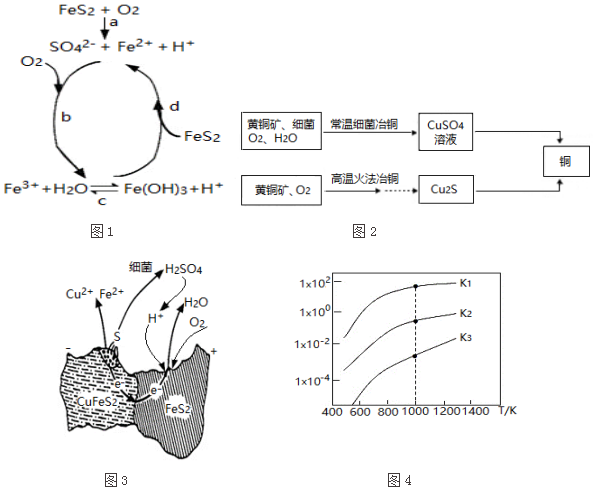
(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示:
①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH增大(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是CuFeS2-4e-=Cu2++Fe2++2S.
②火法冶铜时,由Cu2S制得铜的化学方程式是Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
①上述反应中,△H1>0(填“>”或“<”).
②提高硫的脱除率可采取的措施有升高温度(举1例).

(1)黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步:
①a反应中每生成1molFeSO4转移电子的物质的量为7mol.
②d反应的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+.
(2)用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示:
①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH增大(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是CuFeS2-4e-=Cu2++Fe2++2S.
②火法冶铜时,由Cu2S制得铜的化学方程式是Cu2S+O2 $\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.
| 相关反应 | 反应热 | 平衡常数 |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
②提高硫的脱除率可采取的措施有升高温度(举1例).
3.某化合物X 3.2g在氧气中完全燃烧,只生成4.4gCO2和3.6 H2O,下列说法正确的是( )
| A. | 化合物X是烃类物质 | B. | 化合物X的实验式为CH4 | ||
| C. | 化合物X具有多种同分异构体 | D. | 可以确定化合物X的结构式 |
13.在空气中N2所占的体积分数a,质量分数为b,则空气的平均相对分子质量为( )
| A. | 28b/a | B. | 29a/b | C. | ab/28 | D. | 28a/b |
20.A、B、C、X、Y、Z是元素周期表中的前20号元素,且原子序数依次增大.已知它们的部分化合物的性质如下:
回答下列问题:
(1)写出对应元素的名称:A碳、B氮、C氟、X铝、Y硅、Z氯
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):Ca>Al>Si
(3)写出B的氢化物与C的氢化物反应后生成物的电子式: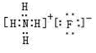 .
.
(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:2F2+2H2O=4HF+O2.
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和“>“、“<“或“=“表示:)CO2<SiO2并说明理由CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合,共价键强度大于分子间作用力,故SiO2熔点比CO2的熔点高.
| A的 氢化物 | B的 氢化物 | C的 氢化物 | X的 氧化物 | Y的氢化物 分子构型 | Z原子 |
| 含氢量最高 的有机物 | 水溶液 呈碱性 | 水溶液 呈酸性 | 两性 氧化物 | 正四面体 | 价电子排布为4s2 |
(1)写出对应元素的名称:A碳、B氮、C氟、X铝、Y硅、Z氯
(2)X、Y、Z三种元素原子半径由大到小的顺序是(用元素符号和“>”表示):Ca>Al>Si
(3)写出B的氢化物与C的氢化物反应后生成物的电子式:
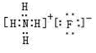 .
.(4)已知C的单质能在水中产生一种常见的氧化性单质,试写出该反应的化学方程式:2F2+2H2O=4HF+O2.
(5)试比较A和Y的最高价氧化物熔点的高低(用具体物质化学式和“>“、“<“或“=“表示:)CO2<SiO2并说明理由CO2为分子晶体,由分子间作用力结合;而SiO2为原子晶体,由共价键结合,共价键强度大于分子间作用力,故SiO2熔点比CO2的熔点高.
13.下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀.
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀.
| A. | ①②③ | B. | ②③⑤ | C. | ②③④ | D. | 全部 |